Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
Chọn \({n_{{N_2}}} = 1\,\,mol\,\,;\,\,{n_{{H_2}}} = 4\,\,mol\)
Phương trình phản ứng hoá học:
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 (1)
bđ: 1 4 0 mol
pư: x 3x 2x mol
dư: 1–x 4–3x 2x mol
Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1–x) + (4–3x) + 2x = 5 – 2x
Áp dụng định luật bảo toàn khối lượng ta có :
mX = mY \( \Leftrightarrow \) nX.\({\overline M _X}\) = nY.\({\overline M _Y}\) \( \Leftrightarrow \)\(\frac{{{{\rm{n}}_{\rm{X}}}}}{{{{\rm{n}}_{\rm{Y}}}}} = \frac{{{{\overline M }_Y}}}{{{{\overline M }_X}}} = \frac{{2.4}}{{1,8.4}} = \frac{5}{{5 - 2x}} \Rightarrow x = 0,25\)
Hiệu suất phản ứng tính theo N2 vì H2 dư : H =\(\frac{{0,25}}{1}.100\% = 25\% \)
Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
Theo giả thiết ta thấy ban đầu ${\rm{[}}{H_2}{\rm{]}} = {\rm{[}}{N_2}{\rm{]}} = 1M$.
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng ${\rm{[}}N{H_3}{\rm{]}} = 0,4M.$
Phương trình phản ứng hoá học :
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 (1)
bđ: 1 1 0
pư: 0,2 ← 0,6 ← 0,4
cb: 0,8 0,4 0,4
Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
\({K_C} = \frac{{{{{\rm{[}}N{H_3}{\rm{]}}}^2}}}{{{\rm{[}}{N_2}{\rm{][}}{H_2}{{\rm{]}}^3}}} = \frac{{{{(0,4)}^2}}}{{0,8.{{(0,4)}^3}}} = 3,125.\)
Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
\(-{n_{N{H_3}}} = 0,1\,\,mol,\,\,{n_{CuO}} = 0,4\,\,mol.\)
- Phương trình phản ứng :
2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O (1)
mol: 0,1 0,4 \( \to \) 0,15
=>
nCuO dư = 0,4 - 0,15 = 0,25mol
A gồm Cu (0,15 mol) và CuO dư (0,25 mol)
- Phản ứng của A với dung dịch HCl :
CuO + 2HCl \( \to \) CuCl2 + H2O (2)
mol: 0,25 \( \to \) 0,5
Theo (2) và giả thiết ta suy ra : VHCl =\(\frac{{0,5}}{2} = 0,25\,lít.\)
Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức
=> kết tủa thu được chỉ gồm Al(OH)3
nAl(OH)3 = nAlCl3 = 0,1 mol => m = 7,8 gam
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của NO3- là :
Khi cho X phản ứng với dung dịch BaCl2 thì xảy ra phản ứng :
Ba2+ + SO42- → BaSO4 (1)
mol: 0,05 → 0,05
=> trong 250 ml dung dịch X có 0,05 mol SO42- vậy trong 500 ml dung dịch X có 0,1 mol SO42-.
Khi cho X phản ứng với dung dịch NH3 dư thì xảy ra các phản ứng :
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+ (2)
mol: 0,1 ← 0,1
Cu2+ + 2NH3 + 2H2O → Cu(OH)2 + 2NH4+ (3)
Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH- (4)
X phản ứng với dung dịch NH3 dư thì chỉ có Al3+ tạo kết tủa, Cu2+ lúc đầu tạo kết tủa sau đó tạo phức tan
Theo (2) và giả thiết ta thấy trong 500 ml dung dịch X có 0,1 mol Al3+.
Đặt số mol của Cu2+ và NO3- trong 500 ml dung dịch X là x và y
Theo định luật bảo toàn điện tích và khối lượng ta có :
\(\left\{ \begin{array}{l}3.{n_{A{l^{3 + }}}} + 2.{n_{C{u^{2 + }}}} = 2.{n_{S{O_4}^{2 - }}} + 1.{n_{N{O_3}^ - }}\\{m_{A{l^{3 + }}}} + {m_{C{u^{2 + }}}} + {m_{C{l^ - }}} + {m_{N{O_3}^ - }} = {m_{muối}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3.0,1 + 2x = 2.0,1 + y\\0,1.27 + 64x + 96.0,1 + 62.y = 37,3\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1\\y = 0,3\end{array} \right.\)
Vậy [NO3-] = \(\dfrac{{0,3}}{{0,5}} = 0,6M\)
Tìm phát biểu không phù hợp với phản ứng này
\({N_2} + 3{H_2} \rightleftarrows 2N{H_3}\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = - 92kJ\)
92kJ là lượng nhiệt tỏa ra chứ không phải lượng nhiệt hấp thụ
Đốt cháy hổn hợp gồm 6,72 lít khí Oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
Phản ứng: 4NH3 + 3O2 → 2N2 + 6H2O
So sánh tỉ lệ thể tích 4 : 3 và 7 : 6,72, ta thấy dư oxi.
Do đó, các chất thu được sau phản ứng là khí nitơ, nước được tạo thành và khí oxi dư.
Trong phòng thí nghiệm, để thử tính chất của khí X người ta đã thực hiện thí nghiệm như hình vẽ dưới đây:
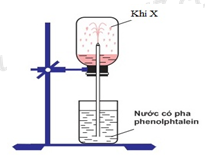
Khí X là:
Khí X làm đổi màu dung dịch phenolphtalein sang màu hồng => khí X tan trong nước, tạo thành dung dịch có tính bazơ => X là NH3
Thành phần của dung dịch NH3 gồm:
\(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + + O{H^ - }\)
Như vậy dung dịch NH3 gồm: NH4+, OH-, NH3 và H2O
Phát biểu nào dưới đây không đúng:
C sai vì NH3 là chất có mùi khai
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
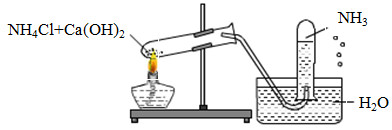
NH3 tan nhiều trong nước nên ta không sử dụng phương pháp đẩy nước để thu khí.
Phản ứng nào dưới đây NH3 không đóng vai trò chất khử?
Phản ứng mà số oxi hóa của N trong NH3 không tăng sau phản ứng thì NH3 không đóng vai trò chất khử
\(A.\,4\mathop N\limits^{ - 3} {H_3} + 5{O_2}\xrightarrow{{{t^0}}}4\mathop N\limits^{ + 2} O + 6{H_2}O\)
\(B.\,2\mathop N\limits^{ - 3} {H_3} + 3\mathop {C{l_2}}\limits^0 \to \mathop {{N_2}}\limits^0 + 6HCl\)
\(C.\,\,\mathop N\limits^{ - 3} {H_3} + {H_2}{O_2} + MnS{O_4} \to Mn{O_2} + {(\mathop N\limits^{ - 3} {H_4})_2}S{O_4}\)
\(D.\,\,\mathop N\limits^{ - 3} {H_3} + 3CuO\xrightarrow{{{t^0}}}3Cu + \mathop {{N_2}}\limits^0 + 3{H_2}O\)
Ta thấy phản ứng ở đán án C NH3 không có sự thay đổi số oxi hóa trước và sau phản ứng → không đóng vai trò là chất khử.
Các phản ứng còn lại số oxi hóa của N trong NH3 đều tăng sau phản ứng nên NH3 đóng vai trò là chất khử
Cho phản ứng: N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/l, N2 là 0,05 mol/l và của H2 là 0,10 mol/l thì hằng số cân bằn của phản ứng là
N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k).
Áp dụng công thức tính hằng số cân bằng:
\(Kc = \frac{{{{[N{H_3}]}^2}}}{{[{N_2}].{{{\rm{[}}{H_2}]}^3}}} = \frac{{0,{3^2}}}{{0,05.0,{1^3}}} = 1800\)
NH3 có thể phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
A. Loại KOH không có pư
B. Thỏa mãn
NH3 + HCl → NH4Cl
NH3 + O2 \(\buildrel {{t^0}} \over\longrightarrow \) N2 + H2O
NH3 + Cl2 → NH4Cl + N2
NH3 + CuO \(\buildrel {{t^0}} \over\longrightarrow \) Cu + N2 + H2O
NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
C. Loại KOH
D. Loại NaOH
Cho sơ đồ phản ứng sau:
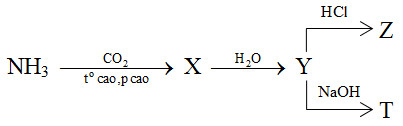
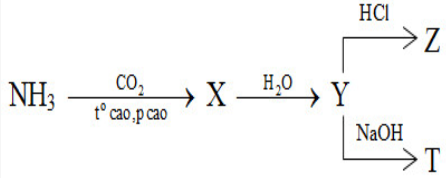
X, Y, Z, T tương ứng là
2NH3 + CO2 \(\xrightarrow{{{t^o}\,cao,\,p\,\,cao}}\) (NH2)2CO (X) + H2O
(NH2)2CO (X) + 2H2O → (NH4)2CO3 (Y)
(NH4)2CO3 (Y) + 2HCl → 2NH4Cl + H2O + CO2 (Z)
(NH4)2CO3 (Y) + 2NaOH → Na2CO3 + 2NH3 (T) + 2H2O
Trong phân tử NH3 chứa liên kết:
Trong phân tử NH3 chứa liên kết cộng hóa trị có phân cực, cặp e dùng chung lệch về phía nguyên tử nito (vì nito có độ âm điện lớn hơn hidro)
Trong công nghiệp, người ta điều chế khí amoniac từ
Trong công nghiệp NH3 được điều chế từ N2 và H2.
N2 + 3H2 \(\underset{{}}{\overset{{{t^0},p,xt}}{\longleftrightarrow}}\) 2NH3
Nung nóng bình kín chứa a mol hỗn hợp NH3 và O2 ( có xúc tác Pt) để chuyển toàn bộ NH3 thành NO. Làm nguội và thêm nước vào bình, lắc đều thu được 1 lít dung dịch HNO3 có pH = 1, còn lại 0,25a mol khí O2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
pH = 1=> [H+] = 10-1 = 0,1 (M) => \({{n}_{HN{{O}_{3}}}}=\text{ }0,1\text{ }\left( mol \right)\)
BTNT Nito \(=>{{n}_{N{{H}_{3}}}}=\text{ }{{n}_{HN{{O}_{3}}}}=\text{ }0,1\text{ }\left( mol \right)\)
\(=>\text{ }{{n}_{{{O}_{2}}(pu)}}=\text{ }a\text{ }\text{- }0,1-0,25a=0,75a-0,1\text{ }\left( mol \right)\)
Sau quá trình
\(\begin{gathered}
\mathop N\limits^{ - 3} {H_3} + 8e\xrightarrow{{}}{N^{ + 5}} \hfill \\
{O_2}\xrightarrow{{}}2{O^{ - 2}} + 4e \hfill \\
\end{gathered} \)
BT e \(:\text{ }=>\text{ }8{{n}_{N{{H}_{3}}}}=\text{ }4{{n}_{{{O}_{2}}}}\)
=> 8.0,1 = 4 (0,75a – 0,1) => a = 0,4 (mol)
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành. Biết hiệu suất chung của phản ứng là 75%. Tìm x?
\(\begin{gathered}
\,\,\,\,\,\,\,\,\,\,{N_2} + 3{H_2}\overset {{t^o},xt,p} \leftrightarrows 2N{H_3} \hfill \\
Bd:x\,\,\,\,\,\,\,\,\,\,12 \hfill \\
Pu:\,\,3\,\,\,\,\,\,\,\,\,\,\,9\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,6 \hfill \\
\end{gathered} \)
Nhận thấy: \(\frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}bd}}}}.100\% = \frac{9}{{12}}.100\% = H\% \)
=> Hiệu suất tính theo H2
Nếu H% tính theo N2 thì:
nN2 bđ = 3.(100/75) = 4
=> nN2 bđ = x ≥ 4
Một bình kín chứa 4 mol khí N2 và 10 mol khí H2 có áp suất là 200atm. Khi đạt trạng thái cân bằng thì áp suất trong bình là 180 atm, nhiệt độ trong bình được giữ không đổi. Tính hiệu suất của phản ứng tổng hợp NH3 trên.
P1V= n1RT (n1=14)
![]()
N2 + 3 H2 <-> 2NH3
có 4 10
p/u x 3x 2x
sau 4-x 10-3x 2x
4-x + 10-3x+ 2x=12,6
=> 14-2x=12,6
=> x=0,7
=> Tính theo H2 => H= 21%

