Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là:
4NH3 + 5O2 -> 4NO + 6H2o
2NO+ O2 -> 2NO2
4NO2 + 2H2O + O2 -> 4HNO3
Bảo toàn N nN(NH3) =nN(HNO3) = 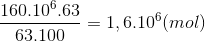
=> 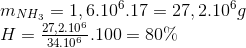
Cho 6 mol N2 và 20 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 18 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 trên.
N2 + 3 H2 <-> 2NH3
có 6 20
p/u x 3x 2x
sau 6-x 20-3x 2x
6-x + 20-3x+ 2x=18
=> 26-2x=18
=> x=4
![]() => Tính H theo N2
=> Tính H theo N2
![]()
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
Gọi số mol ban đầu của N2 là x, H2 : y
N2 + 3 H2 -> 2NH3
bd x y
p/u 0,1x 0,3x 0,2x
Sau 0,9x y-0,3x 0,2x
ns= 0,9x+y-0,3x+0,2x=0,8x+y
![]()
=> 0,95(x+y)= 0,8x+y
=> 0,15x=0,05y
=> y=3x
=> ![]()
Cho các oxit kim loại: CuO, FeO, Al2O3, Na2O, PbO, CaO. Số oxit NH3 có thể khử được:
NH3 chỉ khử được CuO, FeO, PbO
=> khử được 3 chất .
Cho NH3 dư lần lượt vào các dung dịch: CuSO4, AgNO3, Zn( NO3 )2, AlCl3, FeSO4, NaBr, MgCl2. Có bao nhiêu dung dịch tạo phức với NH3 ?
Trừ AlCl3, FeSO4, NaBr, MgCl2
Chú ý đây là phản ứng dùng để phân biệt các hợp chất của Al và Zn
Cho 6,72 lít khí N2 tác dụng với 13,44 lít khí H2 với điều kiện thích hợp thu được V lít hỗn hợp khí (biết H% = 20%). Biết các khí được đo ở điều kiện tiêu chuẩn. Giá trị V là
nN2 = 0,3 mol; nH2 = 0,6 mol
N2 + 3H2 ⇄ 2NH3
Ta có: \(\dfrac{{{n_{{N_2}}}}}{1} > \dfrac{{{n_{{H_2}}}}}{3}\) ⟹ H2 hết và N2 dư.
⟹ nH2pu = 0,6.20% = 0,12 mol
N2 + 3H2 ⇄ 2NH3
0,04 ← 0,12 → 0,08 (mol)
nN2 du = 0,3 - 0,04 = 0,26 mol
nH2 du = 0,6 - 0,12 = 0,48 mol
nhỗn hợp khí = 0,08 + 0,26 + 0,48 = 0,82 mol
⟹ Vkhí = 18,368 lít
Cho 17,92 lít hỗn hợp N2, H2 nung trong điều kiện thích hợp sau một thời gian thu được 13,888 lít hỗn hợp khí với hiệu suất 30% tính theo N2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Thể tích N2 trong hỗn hợp ban đầu là
nkhí ban đầu = 17,92/22,4 = 0,8 mol
nkhí sau = 13,888/22,4 = 0,62 mol
PTHH: N2 + 3H2 ⇄ 2NH3
ngiảm = nNH3 = nkhí bđ – nkhí sau = 0,8 – 0,62 = 0,18 mol
PTHH: N2 + 3H2 ⇄ 2NH3
0,09 ← 0,18
⟹ nN2 pu = 0,09 mol ⟹ nN2 bđ = nN2 pu.100/30 = 0,09.100/30 = 0,3 mol
⟹ VN2 = 0,3.22,4 = 6,72 lít
Nung hỗn hợp X gồm N2 và H2 (biết tỉ khối của X so với H2 bằng 6,2). Sau phản ứng thu được hỗn hợp Y trong đó amoniac chiếm 25% thể tích. Hiệu suất phản ứng là
Xét 1 mol hỗn hợp X và gọi nN2 =x; nH2 = y nên ta có: x + y = 1; 24x + 2y = 12,4 ⟹ x = 0,4; y = 0,6
Xét tỉ lệ \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,4}}{1} > \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,6}}{3}\) ⟹ Tính hiệu suất theo H2
Gọi nNH3 = a mol
PTHH: N2 + 3H2 ⇄ 2NH3.
0,5a 1,5a ← a
nN2 dư = 0,4 – 0,5a; nH2 dư = 0,6 – 1,5a; nNH3 = a
Ta có nNH3 = 25%nY ⟹ \(a = 0,25.(0,4 - 0,5a + 0,6 - 1,5a + a)\)⟹ a = 0,2
nH2 pư = 0,3 mol ⟹ H% = 50%.
Trước đây, trong thời kỳ Chiến tranh Thế giới thứ I, NH3 lỏng từng được thiết kế sử dụng làm thuốc phóng tên lửa. Hiện nay, NH3 được sử dụng nhiều nhất trong sản xuất phân bón và một số hóa chất cơ bản. Trong đó lượng sử dụng cho sản xuất phân bón (cả dạng rắn và lỏng) chiếm đến trên 80% sản lượng NH3 toàn thế giới và tương đương với khoảng 1% tổng công suất phát năng lượng của thế giới. Bên cạnh đó NH3 vẫn được sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản thực phẩm,…), trong các phòng thí nghiệm, trong tổng hợp hữu cơ, hóa dược, y tế và cho các mục đích dân dụng khác. Ngoài ra trong công nghệ môi trường, NH3 còn được dùng để loại bỏ khí SO2 trong khí thải của các nhà máy có quá trình đốt nhiên liệu hóa thạch (than, dầu) và sản phẩm amoni sunfat thu hồi của các quá trình này có thể được sử dụng làm phân bón.
Vì những lí do trên mà trong công nghiệp, có những mối quan tâm nhất định đến quy trình tổng hợp NH3 sao cho đạt hiệu suất cao nhất và hạn chế chi phí một cách tối đa. Vấn đề này có liên quan đến tính hiệu quả và kinh tế của phương pháp Haber tổng hợp amoniac, được biểu diễn bằng phương trình:
N2 (k) + 3H2 (k) ⇄ 2NH3 (k) ; ΔH = -92 kJ.mol-1
Trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là
- Cân bằng có tổng số mol khí ở vế trái bằng 4 mol và vế phải bằng 2 mol. Khi tăng áp suất chung của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng.
- Phản ứng thuận là phản ứng tỏa nhiệt (ΔH < 0) ⟹ Khi giảm nhiệt độ của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng.
Vậy trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là giảm nhiệt độ và tăng áp suất.
Trước đây, trong thời kỳ Chiến tranh Thế giới thứ I, NH3 lỏng từng được thiết kế sử dụng làm thuốc phóng tên lửa. Hiện nay, NH3 được sử dụng nhiều nhất trong sản xuất phân bón và một số hóa chất cơ bản. Trong đó lượng sử dụng cho sản xuất phân bón (cả dạng rắn và lỏng) chiếm đến trên 80% sản lượng NH3 toàn thế giới và tương đương với khoảng 1% tổng công suất phát năng lượng của thế giới. Bên cạnh đó NH3 vẫn được sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản thực phẩm,…), trong các phòng thí nghiệm, trong tổng hợp hữu cơ, hóa dược, y tế và cho các mục đích dân dụng khác. Ngoài ra trong công nghệ môi trường, NH3 còn được dùng để loại bỏ khí SO2 trong khí thải của các nhà máy có quá trình đốt nhiên liệu hóa thạch (than, dầu) và sản phẩm amoni sunfat thu hồi của các quá trình này có thể được sử dụng làm phân bón.
Vì những lí do trên mà trong công nghiệp, có những mối quan tâm nhất định đến quy trình tổng hợp NH3 sao cho đạt hiệu suất cao nhất và hạn chế chi phí một cách tối đa. Vấn đề này có liên quan đến tính hiệu quả và kinh tế của phương pháp Haber tổng hợp amoniac, được biểu diễn bằng phương trình:
N2 (k) + 3H2 (k) ⇄ 2NH3 (k) ; ΔH = -92 kJ.mol-1
Thực hiện phản ứng tổng hợp amoniac trong bình kín ở nhiệt độ xác định. Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độc của phản ứng thuận thay đổi như thế nào so với lúc chưa thay đổi nồng độ?
Tốc độ phản ứng thuận tính theo nồng độ của các chất tham gia phản ứng là v = k.[N2].[H2]3
Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độ phản ứng thuận khi đó:
v' = k.0,5[N2].23[H2]3 = 4.k.[N2].[H2]3 = 4v.
⟹ Tốc độ phản ứng thuận tăng 4 lần khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần.
Trước đây, trong thời kỳ Chiến tranh Thế giới thứ I, NH3 lỏng từng được thiết kế sử dụng làm thuốc phóng tên lửa. Hiện nay, NH3 được sử dụng nhiều nhất trong sản xuất phân bón và một số hóa chất cơ bản. Trong đó lượng sử dụng cho sản xuất phân bón (cả dạng rắn và lỏng) chiếm đến trên 80% sản lượng NH3 toàn thế giới và tương đương với khoảng 1% tổng công suất phát năng lượng của thế giới. Bên cạnh đó NH3 vẫn được sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản thực phẩm,…), trong các phòng thí nghiệm, trong tổng hợp hữu cơ, hóa dược, y tế và cho các mục đích dân dụng khác. Ngoài ra trong công nghệ môi trường, NH3 còn được dùng để loại bỏ khí SO2 trong khí thải của các nhà máy có quá trình đốt nhiên liệu hóa thạch (than, dầu) và sản phẩm amoni sunfat thu hồi của các quá trình này có thể được sử dụng làm phân bón.
Vì những lí do trên mà trong công nghiệp, có những mối quan tâm nhất định đến quy trình tổng hợp NH3 sao cho đạt hiệu suất cao nhất và hạn chế chi phí một cách tối đa. Vấn đề này có liên quan đến tính hiệu quả và kinh tế của phương pháp Haber tổng hợp amoniac, được biểu diễn bằng phương trình:
N2 (k) + 3H2 (k) ⇄ 2NH3 (k) ; ΔH = -92 kJ.mol-1
Nung hỗn hợp khí A gồm 0,1 mol N2; 0,45 mol H2 trong điều kiện thích hợp thu được hỗn hợp B có dA/B = 10/11. Hiệu suất phản ứng là
- Xét tỉ lệ số mol:
\(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,1}}{1} < \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,45}}{3}\)
⟹ Tính hiệu suất phản ứng theo N2.
- BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \)
⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}} \Rightarrow \dfrac{{10}}{{11}} = \dfrac{{{n_B}}}{{0,1 + 0,45}} \Rightarrow {n_B} = 0,5(mol)\)
- Gọi số mol N2 phản ứng là x (mol).
PTHH: N2 + 3H2 ⇄ 2NH3.
x ⟶ 3x → 2x (mol)
⟹ Hỗn hợp B gồm N2 dư: 0,1 – x mol; H2 dư: 0,45 – 3x mol; NH3: 2x mol
⟹ nB = 0,1 – x + 0,45 – 3x + 2x = 0,55 – 2x = 0,5 ⟹ x = 0,025 mol.
Vậy \(H = \dfrac{{{n_{{N_2}(pu)}}.100\% }}{{{n_{{N_2}(bd)}}}} = \dfrac{{0,025.100\% }}{{0,1}} = 25\% \)
Thực hiện phản ứng tổng hợp amoniac từ N2 và H2 với hiệu suất h%, thu được hỗn hợp X chứa 10% NH3 (về thể tích). Cho X tác dụng với CuO dư, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y (gồm khí và hơi) và hỗn hợp rắn Z có khối lượng giảm đi so với khối lượng CuO ban đầu là 12,8 gam. Làm lạnh Y còn 6,72 lít khí (đktc) không bị ngưng tụ. Giá trị của h là
Bước 1: Viết sơ đồ tóm tắt đề bài
- X tác dụng với CuO tạo chất rắn Z giảm đi so với CuO ban đầu ⟹ Có khí H2 dư.
Sau khi làm lạnh Y còn 6,72 lit (đktc) không bị ngưng tụ ⟹ Có khí N2 dư.
- Sơ đồ đề bài:
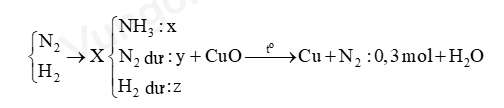
Bước 2: Tính số mol các chất trong X
- mchất rắn giảm = 12,8 gam = m[O] trong CuO
⟹ n[O] trong CuO = 0,8 mol = nCuO
- Đặt nNH3 = x mol ; nN2 dư = y mol ; nH2 = z mol
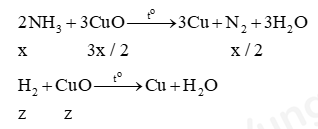
- Lập phương trình tính x, y, z:
(1) Trong hỗn hợp X, NH3 chiếm 10%: $\dfrac{x}{{x + y + z}} = 10\% $
(2) Tổng số mol khí N2: x/2 + y = 0,3
(3) Tổng số mol CuO phản ứng: 3x/2 + z = 0,8
⟹ x = 0,1 ; y = 0,25 ; z = 0,65
Bước 3: Tính hiệu suất phản ứng
- PTHH:
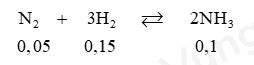
Vì nH2 ban đầu = 0,15 + 0,65 = 0,8 mol ; nN2 ban đầu = 0,05 + 0,25 = 0,3 mol
⟹ Tỉ lệ $\dfrac{{0,8}}{3} < \frac{{0,3}}{1}$ ⟹ Hiệu suất tính theo H2.
⟹ Hiệu suất h = $\dfrac{{0,15}}{{0,15 + 0,65}}.100\% $= 18,75%

