Hoà tan 100 gam P2O5 vào m gam dung dịch H3PO4 48% ta được dung dịch H3PO4 60%. Giá trị của m là :
Trả lời bởi giáo viên
Phương trình phản ứng :
P2O5 + 3H2O → 2H3PO4
142 → 196 gam
100 → x gam
\( \Rightarrow x = \frac{{100.196}}{{142}} = 138\,\,gam\)
Coi P2O5 là dung dịch H3PO4 có nồng độ phần trăm là : C% = \(\frac{{138}}{{100}}.100\% = 138\% \)
Gọi m1, m2 lần lượt là khối lượng của P2O5 và dung dịch H3PO4 48%.
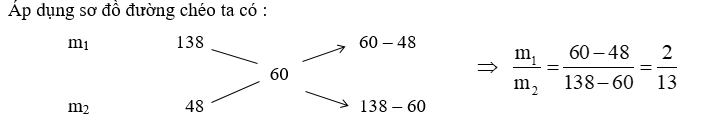
=> \({m_{{\rm{dd}}\,\,{H_3}P{O_4}\,\,48\% }} = {m_2} = \frac{{13}}{2}.100 = 650\,\,gam.\)
Hướng dẫn giải:
+) Tính số mol H3PO4 sinh ra theo PT: P2O5 + 3H2O → 2H3PO4
+) Coi P2O5 là dung dịch H3PO4 có nồng độ phần trăm là : C% = \(\frac{{138}}{{100}}.100\% = 138\% \)
Gọi m1, m2 lần lượt là khối lượng của P2O5 và dung dịch H3PO4 48% => sử dụng sơ đồ đường chéo để giải

