Nung nóng hỗn hợp X gồm metan, etilen, propin, vinyl axetilen và a mol H2 có Ni xúc tác (chỉ xảy ra phản ứng cộng H2) thu được 0,2 mol hỗn hợp Y (gồm các hiđrocacbon) có tỉ khối so với H2 là 14,5. Biết 0,2 mol Y phản ứng tối đa với 0,1 mol Br2 trong dung dịch. Giá trị của a là
Bước 1: Xác định CT trung bình của Y
Đặt CT trung bình của Y là CnH2n+2-2k.
- Xét phản ứng của Y và Br2:
nY = 0,2 mol; nBr2 = 0,1 mol.
CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k
0,2 → 0,2k (mol)
Mà nBr2 = 0,2k = 0,1 → k = 0,5.
Do MY = 14,5.MH2 = 29 nên 14n + 2 - 2k = 29 → n = 2.
→ CT trung bình của Y: C2H5.
Bước 2: Xác định CT trung bình của X
- Do các hiđrocacbon trong X đều có 4H và phản ứng cộng không làm thay đổi số C
⟹ CT trung bình của X: C2H4.
Bước 3: Tính nH2
- Xét phản ứng X + H2 (a mol):
C2H4 + 0,5H2 → C2H5
0,1 ← 0,2 (mol)
Vậy a = 0,1 mol.
Hỗn hợp khí X gồm etilen và axetilen. Cho 6,8 gam X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 24,0 gam kết tủa. Mặt khác, cho 6,8 gam X phản ứng với Br2 trong dung dịch. Số mol Br2 phản ứng tối đa là (Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Br = 80; Ag = 108.)
Bước 1: Tính nC2H2 và nC2H4
- Khi X + AgNO3 thì chỉ có C2H2 phản ứng:
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
⟹ nC2H2 = nC2Ag2 = 24/240 = 0,1 mol
⟹ mC2H2 = 0,1.26 = 2,6 gam
⟹ mC2H4 = 6,8 - 2,6 = 4,2 gam
⟹ nC2H4 = 4,2/28 = 0,15 mol
Bước 2: Viết PTHH của X tác dụng với Br2
- Khi X + Br2 thì cả 2 chất đều phản ứng:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
Bước 3: Tính nBr2
Theo PTHH: nBr2 = 2nC2H2 + nC2H4 = 2.0,1 + 0,15 = 0,35 mol.
Cho ba hiđrocacbon X, Y, Z. Nếu đốt cháy 0,2 mol mỗi chất thì thể tích khí CO2 thu được không quá 14 lít (đo ở đktc). Thực hiện các thí nghiệm thấy có hiện tượng như bảng sau:
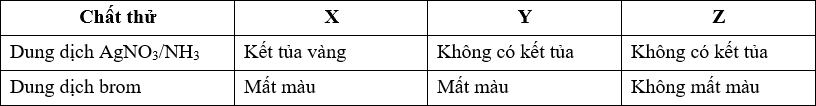
Công thức cấu tạo của X, Y, Z là
- Theo đề bài ta có nCO2 < 14/22,4 = 0,625 mol
Số C < 0,625/0,2 = 3,125 ⟹ X, Y, Z đều có số C nhỏ hơn 3,125.
- X tác dụng AgNO3/NH3 và làm mất màu dung dịch Br2
⟹ X có liên kết ba đầu mạch (C < 3,125).
- Y làm mất màu dung dịch Br2 nhưng không tác dụng AgNO3/NH3
⟹ Y có liên kết đôi C=C (C < 3,125).
- Z không làm mất màu dung dịch Br2 và không tác dụng với AgNO3/NH3 ⟹ Z là ankan (C < 3,125).
- Kết hợp với đáp án ⟹ X, Y, Z lần lượt là CH≡C-CH3; CH2=CH-CH3, CH3-CH3.
Hỗn hợp A gồm 3 chất X, Y, Z là 3 hiđrocacbon mạch hở có cùng công thức đơn giản nhất (theo thứ tự tăng dần về số nguyên tử cacbon), trong đó C chiếm 92,31% về khối lượng. Khi đốt cháy 0,01 mol chất Z thu được không quá 2,75 gam CO2. Cho 3,12 gam hỗn hợp A (có số mol các chất bằng nhau) tác dụng với lượng dư dung dịch AgNO3/NH3 thu được tối đa m gam kết tủa. Giá trị của m là (cho NTK: H = 1; C = 12; O = 16; Ag = 108)
Bước 1: Xác định CTĐGN của 3 chất
Ta có: %mH = 100% - 92,31% = 7,69%.
→ \(C:H = \dfrac{{92,31}}{{12}}:\dfrac{{7,69}}{1} = 1:1\) → CTĐGN là CH.
Bước 2: Biện luận tìm CTPT của X, Y, Z
- Khi đốt cháy 0,01 mol chất Z thu được không quá 2,75 gam CO2
\( \to {n_{C{O_2}}} < \dfrac{{2,75}}{{44}} = 0,0625\)
\( \to {C_Z} < \dfrac{{0,0625}}{{0,01}} = 6,25\).
- Mặt khác số nguyên tử H luôn là số chẵn nên suy ra: X là C2H2, Y là C4H4 và Z là C6H6.
Bước 3: Xác định CTCT của X, Y, Z thoả mãn bài toán
- Cho 3,12 gam hỗn hợp A (có số mol các chất bằng nhau) tác dụng với lượng dư dung dịch AgNO3/NH3:
nX = nY = nZ = \(\dfrac{{3,12}}{{26 + 52 + 78}}\) = 0,02 mol
Để lượng kết tủa tối đa thì CTCT của các chất là:
C2H2: CH≡CH (0,02 mol)
C4H4: CH≡C-CH=CH2 (0,02 mol)
C6H6: CH≡C-CH2-CH2-C≡CH (0,02 mol)
Bước 4: Tính khối lượng kết tủa
Kết tủa gồm:
CAg≡CAg (0,02 mol)
CAg≡C-CH=CH2 (0,02 mol)
CAg≡C-CH2-CH2-C≡CAg (0,02 mol)
⟹ mkết tủa = 0,02.240 + 0,02.159 + 0,02.292 = 13,82 gam.

