Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
Al, Fe là những kim loại bị thụ động với HNO3 đặc nguội
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
2AgNO3 + Fe → 2Ag + Fe(NO3)2
AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
P2O5 + 3H2O → 2 H3PO4
m/142 2m/142 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nNaOH = 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4 = mmuối + mH2O → 0,7.40 + (2m/142).98 = 2,1033m + 0,7.18 → m = 21,3 gam
→ nP2O5 = 0,15 mol.
Do đó ta có tỉ lệ \(\frac{{{n_{P2O5}}}}{{{n_{NaOH}}}} = \frac{{0,15}}{{0,7}} = 0,214\)
Nhiệt phân hoàn toàn 37,8 gam muối nitrat có hóa trị không đổi thu được oxit kim loại và 11,2 lít hỗn hợp khí (đktc) có khối lượng 21,6 gam. Công thức của muối nitrat là
Bước 1: Tính số mol mỗi khí trong hỗn hợp ban đầu
Xét hỗn hợp khí gồm NO2 (a mol) và O2 (b mol):
⟹ nkhí = a + b = 0,5 (1)
⟹ mkhí = 46a + 32b = 21,6 (2)
Giải hệ trên được a = 0,4 và b = 0,1
Bước 2: Viết PTHH tìm số mol muối nitrat
2M(NO3)n → M2On + 2nNO2 + 0,5nO2
0,4/n ← 0,4
Bước 3: Lập phương trình mối liên hệ giữa M và n. Biện luận với n = 1; 2; 3.
⟹ mmuối = 0,4/n.(M + 62n) = 37,8 ⟹ M = 32,5n
Biện luận với n = 1, 2, 3:
+ Nếu n = 1 ⟹ M = 32,5 (loại).
+ Nếu n = 2 ⟹ M = 65 (Zn).
+ Nếu n = 3 ⟹ M = 97,5 (loại).
Vậy công thức của muối nitrat là Zn(NO3)2.
Nhiệt phân hoàn toàn 22,2 gam muối nitrat của kim loại có hóa trị không đổi thu được oxit kim loại và hỗn hợp khí X. Hòa tan hỗn hợp khí X trong 3 lít nước thu được dung dịch axit có pH = 1. Công thức hóa học của muối là
Bước 1: Tính số mol HNO3
pH = 1 ⟹ [H+] = 0,1M = CM HNO3 ⟹ nHNO3 = 0,3 mol
Bước 2: Tính số mol muối nitrat
2NO2 + 0,5O2 + H2O → 2HNO3
0,3 ← 0,3
2M(NO3)n → M2On + 2nNO2 + 0,5nO2
0,3/n ← 0,3
Bước 3: Biện luận tìm muối nitrat
⟹ Mmuối = 22,2 : (0,3/n) = 74n
⟹ M + 62n = 74n
⟹ M = 12n
Biện luận với n = 1; 2; 3 ta có:
+ n = 1 ⟹ M = 12 (loại)
+ n = 2 ⟹ M = 24 (Mg)
+ n = 3 ⟹ M = 36 (loại)
Vậy muối có công thức là Mg(NO3)2.
Bước 1: Xác định thành phần chất Y
2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
⟹ Chất rắn Y gồm Fe2O3 và Al2O3
Bước 2: Tính nFe2O3 và nAl2O3
Khi cho Y vào NaOH thì chỉ có Al2O3 phản ứng
2NaOH + Al2O3 → 2NaAlO2 + H2O.
0,3 → 0,15
⟹ mAl2O3 = 102.0,15 = 15,3 gam
⟹ mFe2O3 = mchất rắn - mAl2O3 = 47,3 - 15,3 = 32 gam
⟹ nFe2O3 = 0,2 mol
Bước 3: Tính m gam hh Al(NO3)3 và Fe(NO3)2
Bảo toàn nguyên tố Fe ⟹ nFe(NO3)2 = 2nFe2O3 = 0,4 mol ⟹ mFe(NO3)2 = 72 gam
Bảo toàn nguyên tố Al ⟹ nAl(NO3)3 = 2nAl2O3 = 0,3 mol ⟹ mAl(NO3)3 = 63,9 gam
⟹ m = mFe(NO3)2 + mAl(NO3)3 = 135,9 gam.
Nhiệt phân hoàn toàn 52,8 gam hỗn hợp Cu(NO3)2; AgNO3 thu được chất rắn X. Hòa tan X trong dung dịch HNO3 dư thấy thoát ra 4,48 lít khí NO2 (đktc). Khối lượng Cu(NO3)2 trong hỗn hợp là
Bước 1: Viết sơ đồ tóm tắt
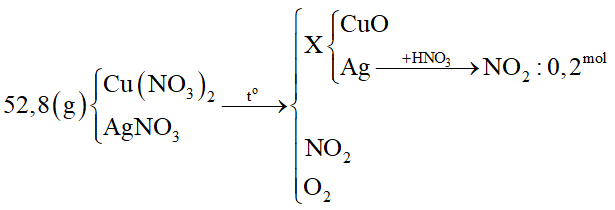
Bước 2: Tính nAg
- Khi cho X phản ứng với HNO3 dư thì chỉ có phản ứng oxi hóa - khử giữa Ag và HNO3:
N+5 + 1e → N+4
0,2 ← 0,2
Ag → Ag+ + 1e
0,2 ← 0,2
Bước 3: Tính khối lượng Cu(NO3)2
- Bảo toàn Ag ⟹ nAgNO3 = nAg = 0,2 mol
⟹ mAgNO3 = 0,2.170 = 34 gam
⟹ mCu(NO3)2 = mhh – mAgNO3 = 52,8 - 34 = 18,8 gam.
Nhiệt phân hoàn toàn 28,2 gam muối nitrat của kim loại hóa trị không đổi thu được oxit kim loại và thấy khối lượng chất rắn giảm 16,2 gam so với lượng ban đầu. Công thức của muối nitrat là
Bước 1: Tính nNO2
Gọi số mol khí NO2 là a (mol)
2M(NO3)n → M2On + 2nNO2 + n/2 O2
a/n ← a → 0,25a
Ta có: mchất rắn giảm = mNO2 + mO2 ⟹ 46.a + 32.0,25a = 16,2 ⟹ a = 0,3 mol
Bước 2: Tính nmuối nitrat
- Theo PTPƯ: nmuối nitrat = a/n = 0,3/n mol
Bước 3: Tìm CT muối nitrat
- Mmuối = 28,2 : (0,3/n) = 94n ⟹ M + 62n = 94n
⟹ M = 32n
- Biện luận với n = 1; 2; 3 ta có:
+ n = 1 ⟹ M = 32 (loại)
+ n = 2 ⟹ M = 64 (Cu)
+ n = 3 ⟹ M = 96 (loại)
Vậy muối có công thức là Cu(NO3)2.
Để 26,88 gam phôi Fe ngoài không khí một thời gian, thu được hỗn hợp rắn X gồm Fe và các oxit. Hòa tan hết X trong 288 gam dung dịch HNO3 31,5%, thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn Y, rồi nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Xác định nồng độ % Fe(NO3)3 trong Y?
Bước 1: Tính nFe(NO3)2 và nFe(NO3)3
- Cô cạn Y thu được chất rắn khan gồm Fe(NO3)2 (a mol) và Fe(NO3)3 (b mol).
Bảo toàn nguyên tố Fe ta có: a + b = nFe = 26,88 : 56 = 0,48 (mol).
2 Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2
a mol → 2a 0,25a
2 Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2
b mol → 3b 0,75b
- Sau khi nung đến khối lượng không đổi thì khối lượng chất rắn giảm chính là tổng khối lượng NO2 và O2 thoát ra: 46(2a + 3b) + 32(a/4 + 3b/4) = 67,84
Ta có hệ: \(\left\{ \begin{array}{l}a + b = 0,48\\46(2a + 3b) + 32(0,25a + 0,75b) = 67,84\end{array} \right. \to \left\{ \begin{array}{l}a = 0,16{\rm{ mol}}\\{\rm{b = 0,32 mol}}\end{array} \right.\)
→ nNO3- (Y) = 2a + 3b = 2.0,16 + 3.0,32 = 1,28 mol
Bước 2: Tính nO (Z)
- Ta có: nHNO3 ban đầu = 1,44 mol
Bảo toàn nguyên tố N: nN(trong Z) = nHNO3 - nNO3- (Y) = 1,44 - 1,28 = 0,16 mol
- Vì trong hỗn hợp khí Z oxi chiếm 61,11% về khối lượng nên nitơ chiếm 38,89% về khối lượng.
→ mZ = mN.(100/38,89) = 0,16.14.(100/38,89) = 5,76 gam
Ta có: nO (Z) = 5,76.61,11%/16 = 0,22 (mol)
Bước 3: Tính mX
- Quy đổi X thành Fe (0,48 mol) và O (x mol).
Áp dụng định luật bảo toàn electron: 2.nFe2+ + 3.nFe3+ + 2.nO (Z) = 2.nO (X) + 5.nN (Z)
⟹ 0,16.2 + 0,32.3 + 0,22.2 = 2x + 0,16.5 → x = 0,46 mol
→ mX = mFe + mO = 26,88 + 0,46.16 = 34,24 (gam)
Bước 4: Tính C%Fe(NO3)3
Sơ đồ: X + HNO3 → Muối + Z + H2O
- Áp dụng định luật bảo toàn khối lượng ta có:
mdung dịch Y = mX + mdd HNO3 - mZ = 34,24 + 288 - 5,76 = 316,48 (gam)
- Vậy \(C{\% _{Fe\left({NO3} \right)3}} = \dfrac{{0,32.242.100\% }}{{316,48}} = {\text{ }}24,47\% \)
Nhiệt phân hoàn toàn hỗn hợp chất rắn X gồm Cu(NO3)2 và AgNO3. Hỗn hợp khí thu được cho lội qua nước lạnh thu được dung dịch Y và 168ml khí Z không màu (ở điều kiện tiêu chuẩn). Cho Y tác dụng với lượng vừa đủ dung dịch NaOH thu được dung dịch chứa 9,35 gam một muối. Phần trăm khối lượng AgNO3 trong X là
(Cho biết nguyên tử khối của các nguyên tố: H = 1; N = 14; O = 16; Na = 23; Cu = 64; Ag = 108.)
Bước 1: Viết PTHH nhiệt phân muối nitrat.
- Đặt nCu(NO3)2 = x mol; nAgNO3 = y mol.
Cu(NO3)2 → CuO + 2NO2 + 0,5O2
x → 2x → 0,5x (mol)
AgNO3 → Ag + NO2 + 0,5O2
y → y → 0,5y (mol)
Hỗn hợp khí gồm (2x + y) mol NO2 và (0,5x + 0,5y) mol O2.
Bước 2: Tính số mol Cu(NO3)2 và AgNO3.
- Cho hỗn hợp khí qua nước:
4NO2 + O2 + 2H2O → 4HNO3
(2x+y) → (0,5x+0,25y) → (2x+y) (mol)
+ Khí Z: nO2 dư = (0,5x + 0,5y) - (0,5x + 0,25y) = 0,25y (mol)
⟹ 0,25y = 0,168/22,4
⟹ y = 0,03 (*)
+ DD Y: HNO3 (2x + y mol)
- HNO3 + NaOH → NaNO3 + H2O
(2x+y) → (2x+y) (mol)
⟹ mmuối = 85.(2x + y) = 9,35 (**)
Từ (*) và (**) ⟹ x = 0,04; y = 0,03.
Bước 3: Tính %mAgNO3
%mAgNO3 = \(\dfrac{{170.0,03}}{{188.0,04.170.0,03}}.100\% \) = 40,41%.
Phần lớn nitric acid được sản xuất ra dùng để
Phần lớn nitric acid được sản xuất ra dùng để điều chế phân đạm
Phương trình hóa học của phản ứng nào không dùng trong việc điều chế HNO3 trong công nghiệp?
Trong công nghiệp, HNO3 được điều chế trải qua 3 giai đoạn:
- Giai đoạn 1: $2N{H_3} + \tfrac{5}{2}{O_2}\xrightarrow{{{t^0},xt}}2NO + 3{H_2}O$
- Giai đoạn 2: \(2NO + {O_2} \to 2N{O_2}\)
- Giai đoạn 3: \(2N{O_2} + {\textstyle{1 \over 2}}{O_2} + {H_2}O \to 2HN{O_3}\)
=> Phương trình của phản ứng không dùng trong việc điều chế HNO3 trong công nghiệp là
$NaN{O_3} + {H_2}S{O_4}\xrightarrow{{{t^0}}}HN{O_3} + NaHS{O_4}.$
Muối nitrat là muối của
Muối nitrat là muối của axit nitric
Đâu là phát biểu không đúng khi nói về muối nitrat?
Muối nitrat là chất điện li mạnh
Thuốc nổ đen chứa
Thuốc nổ đen chứa 75% KNO3, 10%S và 15%C.
Phần lớn muối nitrat dùng để
Phần lớn muối nitrat dùng để làm phân đạm
Cho hỗn hợp gồm 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, ở đktc). X là
Gọi công thức cấu tạo của X là NxOy (với 1 ≤ x ≤ 2 ; 1 ≤ y ≤ 5 đều nguyên).
Quá trình nhường electron:
\(\begin{array}{*{20}{c}}{Mg}\\{0,15}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{M{g^{2 + }}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{2e}\\{0,3}\end{array}\)
Quá trình nhận electron:
\(\begin{array}{*{20}{c}}{x{N^{ + 5}}}\\{}\end{array}\begin{array}{*{20}{c}}{ + (5x - 2y)e}\\{0,1(5x - 2y)}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{N_x^{ + 2y/x}}\\{0,1}\end{array}\)
Áp dụng BT electron: 0,1(5x-2y) = 0,3 => 5x-2y=3
Từ các lựa chọn => x=y=1 => X là NO
Hòa tan 0,2 mol Fe và 0,3 mol Mg vào dung dịch HNO3 dư thu được 0,4 mol một sản phẩm khử chứa N duy nhất. Sản phẩm khử là
Gọi công thức cấu tạo của X là NxOy (với 1 ≤ x ≤ 2 ; 1 ≤ y ≤ 5 đều nguyên).
Qúa trình nhường electron:
\(\begin{array}{*{20}{c}}{Fe}\\{0,2}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{F{e^{3 + }}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{3e}\\{0,6}\end{array}\)
\(\begin{array}{*{20}{c}}{Mg}\\{0,3}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{M{g^{2 + }}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{2e}\\{0,6}\end{array}\)
Quá trình nhận electron:
\(\begin{array}{*{20}{c}}{x{N^{ + 5}}}\\{}\end{array}\begin{array}{*{20}{c}}{ + (5x - 2y)e}\\{0,4(5x - 2y)}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{N_x^{ + 2y/x}}\\{0,4}\end{array}\)
Áp dụng BT electron: 0,4(5x-2y)=0,6+0,6=1,2 => 5x-2y=3
Từ các lựa chọn => x=y=1 => X là NO
Hòa tan hoàn toàn 11,2 gam Fe vào dung dịch HNO3 dư thu được dung dịch A và 6,72 lít hỗn hợp khí B gồm NO và một khí X với tỉ lệ thể tích là 1:1. X là
Gọi công thức cấu tạo của X là NxOy (với 1 ≤ x ≤ 2 ; 1 ≤ y ≤ 5 đều nguyên).
Qúa trình nhường electron:
\(\begin{array}{*{20}{c}}{Fe}\\{0,2}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{F{e^{3 + }}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{3e}\\{0,6}\end{array}\)
Quá trình nhận electron:
\(\begin{array}{*{20}{c}}{{N^{ + 5}}}\\{}\end{array}\begin{array}{*{20}{c}}{ + 3e}\\{0,45}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{{N^{ + 2}}}\\{0,15}\end{array}\)
\(\begin{array}{*{20}{c}}{x{N^{ + 5}}}\\{}\end{array}\begin{array}{*{20}{c}}{ + (5x - 2y)e}\\{0,15(5x - 2y)}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{N_x^{ + 2y/x}}\\{0,15}\end{array}\)
Áp dụng BT electron: 0,15(5x-2y) + 0,45 = 0,6=> 5x-2y=1
Từ các lựa chọn => x=1; y=2 => X là NO2

