Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là :
Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là dung dịch KMnO4
Benzen: không hiện tượng
Sitren: mất màu ở nhiệt độ thường
Toluen: mất màu khi đun nóng
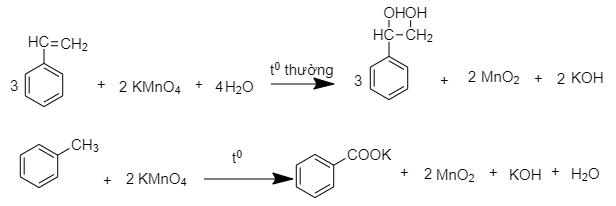
Để phân biệt được các chất hex-1-in, toluen, benzen ta dùng 1 thuốc thử duy nhất là:
- dùng dung dịch KMnO4
Hex-1-in: mất màu ở nhiệt độ thường
Toluen: Mất màu khi đun nóng
Benzen không phản ứng
A có công thức phân tử là C8H8, tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức. 1 mol A tác dụng tối đa với:
Tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức => chứa nối đôi C=C
=> A là C6H5-CH=CH2 (stiren)
=> 1 mol A tác dụng tối đa với 4 mol H2 ; 1 mol brom.
Tiến hành trùng hợp 10,4 gam stiren được hỗn hợp X gồm polistiren và stiren (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp stiren là:
${n_{{C_8}{H_8}}} = \frac{{10,4}}{{104}} = 0,1\,\,mol;\,\,{n_{B{r_2}}} = 0,15.0,2 = 0,03\,\,mol;\,\,{n_{{I_2}}} = \frac{{1,27}}{{254}} = 0,005\,\,mol.$
Phương trình phản ứng :
$nCH({C_6}{H_5}) = C{H_2}\,\,\,\;\xrightarrow{{xt,\,\,\,\,\,{t^o}}}{{\text{[ - }}CH({C_6}{H_5}) - C{H_2} - {\text{]}}_n}$ (1)
mol: 0,075
${C_6}{H_5} - CH = C{H_2}\, + \,B{r_2}\; \to \;\;{C_6}{H_5} - CHB{\text{r}} - C{H_2}B{\text{r}}$ (2)
mol: 0,025 → 0,025
KI + Br2 → KBr + I2 (3)
mol: 0,005 → 0,005
Theo (3) : n Br2 dư = 0,005 =>nBr2 phản ứng = nC8H8 dư = 0,025 mol
=> nC8H8 phản ứng = 0,075 mol => H =$\dfrac{{0,075}}{{0,1}}.100 = 75\% $
Đề hiđro hoá etylbenzen ta được stiren; trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
Sơ đồ phản ứng:
$n{C_6}{H_5}C{H_2}C{H_3}\xrightarrow{{-{H_2},\,{t^o},\,xt}}n{C_6}{H_5}CH = C{H_2}\;\xrightarrow{{{t^o},\,p,\,xt}}{\rlap{-} (\,CH({C_6}{H_5})-C{H_2}\rlap{-} )_n}$
gam: 106n → 104n
tấn: x.80% → 10,4
Vậy khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polistiren với hiệu suất 80% là :
x = $\frac{{10,4.106n}}{{104n.80\% }} = 13,25$ tấn
1,3 gam chất hữu cơ A cháy hoàn toàn thu được 4,4 gam CO2 và 0,9 gam H2O. Tỉ khối hơi của A đối với oxi là d thỏa mãn điều kiện 3 < d < 3,5. Công thức phân tử của A là :
nCO2 = 0,1 mol; nH2O = 0,05 mol
Bảo toàn nguyên tố C và H: nC (trong A) = nCO2 = 0,1 mol; nH (trong A) = 2.nH2O = 0,1 mol
=> mC + mH = 0,1.12 + 0,1 = 1,3 = mA => trong A không chứa O
CTPT của A là (CH)n
Ta có: $3 < {d_{A/O2}} < 3,5{\text{ }} = > {\text{ }}3 < \frac{{13n}}{{32}}{\text{ < }}3,5{\text{ }} = > 7 < n < 8,6\,\, = > \,\,n = 8$
=> CTPT của A là C8H8
Đốt cháy hết 9,18 gam hai đồng đẳng kế tiếp thuộc dãy của stiren A, B thu được H2O và 30,36 gam CO2. Công thức phân tử của A và B lần lượt là :
nCO2 = 0,69 mol
Gọi CTPT chung của A và B là CnH2n-8
CnH2n-8 + O2 → nCO2 + (n – 4)H2O
=> đốt cháy A và B thu được nCO2 – nH2O = 4.nCnH2n-8
mhiđrocacbon = mC + mH => mH = 9,18 – 0,69.12 = 0,9 gam => nH2O sinh ra = nH / 2 = 0,45 mol
=> nCnH2n-8 = (0,69 – 0,45) / 4 = 0,06 mol
=> số C trung bình = nCO2 / nCnH2n-8 = 11,5 => A và B là C11H14 và C12H16
Đốt X thu được ${m_{C{O_2}}}:\,\,{m_{{H_2}O}}\,\, = \,\,44\,\,:\,\,9$ . Biết X làm mất màu dung dịch brom. X là :
${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} = 1:0,5$
=> nC : nH = 1 : 1 => CTĐGN của X là CH
Vì X làm mất màu dung dịch brom => X có liên kết đôi hoặc liên kết 3
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với = 44 : 9. Biết MA < 150. A có công thức phân tử là :
Coi thể tích như số mol => đốt cháy 1 mol A cần 10 mol oxi
${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} = 1:0,5$
Gọi nCO2 = a mol => nH2O = 0,5a
Bảo toàn oxi: 2nO2 = 2.nCO2 + nH2O => 2a + 0,5a = 2.10 => a = 8
=> nCO2 = 8 mol; nH2O = 4 mol
=> A: C8H8

