Cho phản ứng: \({C_2}{H_2} + {H_2}O\xrightarrow{{{t^0},xt}}A\)
A là chất nào dưới đây?
\(CH \equiv CH + {H_2}O\xrightarrow{{{t^0},xt}}C{H_3}CHO\)
Để chuyển hóa ankin thành anken ta thực hiện phản ứng cộng H2 trong điều kiện có xúc tác
Để chuyển hóa ankin thành anken ta thực hiện phản ứng cộng H2 trong điều kiện có xúc tác Pd/PbCO3 đun nóng
VD: CH≡C–CH2–CH3 + H2 \(\xrightarrow{{Pd/PbC{O_3}}}\) CH2=CH–CH2–CH3
Cho dãy chuyển hóa sau:
\(C{H_4} \to A \to B \to C \to \) cao su buna
Công thức phân tử của B là
\(\begin{gathered}C{H_4}\xrightarrow{{ - {H_2},{{1500}^o}C}}CH \equiv CH\xrightarrow{{\dim ehoa}}C{H_2} = CH - C \equiv CH \hfill \\\xrightarrow{{ + {H_2}(Pd/PbC{O_3})}}C{H_2} = CH - CH = C{H_2}\xrightarrow{{{t^o},xt,p}}{\left( { - C{H_2} - CH = CH - C{H_2} - } \right)_n} \hfill \\ \end{gathered} \)
Vậy Y là C4H4
Cho chuỗi phản ứng sau:
\(N + {H_2}\xrightarrow{B}D\xrightarrow{{HCl}}E(spc)\xrightarrow{{K{\text{O}}H}}D\)
Xác định N, B, D, E biết rằng D là một hiđrocacbon mạch hở, D chỉ có 1 đồng phân.
\(CH \equiv C - C{H_3} + {H_2}\xrightarrow{{xt:Pd/PbC{O_3},{t^0}}}C{H_2} = CH - CH3\xrightarrow{{ + HCl}}C{H_3} - CHCl - C{H_3}\xrightarrow({xt:ancol,{t^0}})C{H_2} = CH - C{H_3}\)
N là CH≡C-CH3 (C3H4)
B là Pd
D là CH2=CH-CH3 (C3H6)
E là CH3-CHCl-CH3
Một hỗn hợp gồm etilen và axetilen có thể tích 6,72 lít (đktc). Cho hỗn hợp đó qua dung dịch brom dư để phản ứng xảy ra hoàn toàn, lượng brom phản ứng là 64 gam. Thành phần % về thể tích etilen và axetilen lần lượt là
Gọi n etilen = a mol, n axetilen = b mol => a + b = 0,3 (1)
Ta có: nBr2 = n etilen + 2. axetilen
=> a + 2b = 0,4 (2)
Từ (1) và (2) => a = 0,2 mol; b = 0,1 mol
=> % n axetilen = 0,1.100/0.3 = 33,33%
=> % n etilen = 66,67%
Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nặng hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng . Giá trị của m là
Hidrocacbon là C2H2 (vì M < Mkk; nBr2 = 2nankin)
nBr2 = 0,16 mol; nCO2 = 0,16 mol=> nankin = 0,08 mol
m = 0,08.26 = 2,08 gam
Dẫn 1,68 lít hỗn hợp khí X gồm hai hiđrocacbon vào bình đựng dung dịch brom (dư). Sau khi phản ứng hoàn toàn, có 4 gam brom đã phản ứng và còn lại 1,12 lít khí. Nếu đốt cháy hoàn toàn 1,68 lít X thì sinh ra 2,8 lít khí CO2 (đktc). Công thức phân tử của hai hiđrocacbon là
nX = 0,075 mol; nBr2 = 0,025 mol
n khí còn lại = 0,05 mol
Do đó X gồm 1 hiđrocacbon no (có số mol là 0,05) và 1 hiđrocacbon không no (có số mol là 0,025 mol)
Mà n hiđrocacbon không no = n Br2 nên hiđrocacbon không no đó là anken có công thức CnH2n
Mặt khác:
\({\overline C _x} = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = \frac{{\frac{{2,8}}{{22,4}}}}{{0,075}} = 1,67\)
Do đó hiđrocacbon no là CH4
Ta có: \(1,67 = \frac{{1.\,0,05 + n.0,025}}{{0,075}} = > n = 3 = > {C_3}{H_6}\)
Cho etin phản ứng với dung dịch brom dư thu được sản phẩm là
CH≡CH + 2Br2 → CHBr2 – CHBr2
Cho propin qua nước có HgSO4 ở 80oC tạo ra sản phẩm là
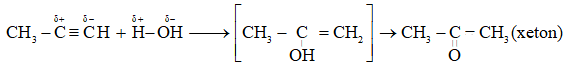
Cho hỗn hợp but-1-in và hiđro dư qua xúc tác Pd/PbCO3 đun nóng, sản phẩm tạo ra là
CH≡C–CH2–CH3 + H2 $\xrightarrow{Pd/PbC{{O}_{3}}}$ CH2=CH–CH2–CH3
Cho phản ứng C2H2 + H2O → A. Chất A là
C2H2 + H2O $\xrightarrow{HgS{{O}_{4}},\,\,{{t}^{o}}}$ CH3–CHO
Cho propen, propin, đivinyl tác dụng với HCl (tỉ lệ 1 : 1), số sản phẩm thu được lần lượt là
Propen: CH2=CH-CH3 + HCl → CH3-CHCl-CH3 + CH2Cl-CH2-CH3
Propin: CH≡C-CH3 + HCl → CH2=CCl-CH3 + CHCl=CH-CH3 (có đphh)
=> propin thu được 3 sản phẩm
Đivinyl: CH2=CH-CH=CH2 có 2 kiểu cộng 1,2 và cộng 1,4 (xem lại lí thuyết ankađien)
CH2=CH-CH=CH2 + HCl → CH2=CH-CH2-CH2Cl + CH2=CH-CHCl-CH3
CH2=CH-CH=CH2 + HCl → CH3-CH=CH-CHCl (có đphh)
=> đivinyl thu được 4 sản phẩm
Khi cho brom hóa hoàn toàn 0,3 mol hỗn hợp gồm một ankin và một anken cần vừa đủ 0,4 mol Br2. Thành phần phần trăm về số mol của ankin trong hỗn hợp là:
Gọi n anken = a mol, n ankin = b mol => a + b = 0,3 (1)
Ta có: nBr2 = nanken + 2. nankin
=> a + 2b = 0,4 (2)
Từ (1) và (2) => a = 0,2 mol; b = 0,1 mol
=> % n ankin = 0,1.100/0.3 = 33,33%
Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch Br2 dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích O2 (đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X?
+) Vì thể tích hỗn hợp qua dung dịch Br2 giảm 1 nửa => nankan = nankin
=> đốt cháy hỗn hợp X thu được ${{n}_{C{{O}_{2}}}}=\text{ }{{n}_{{{H}_{2}}O}}=\text{ }x\text{ }mol$
+) Ta có: ${{m}_{X}}={{m}_{C}}+{{m}_{H}}=12.{{n}_{C{{O}_{2}}}}+2.{{n}_{{{H}_{2}}O}}=>\text{ }12x+2x=3,5~$
=> x = 0,25 mol
+) Bảo toàn O: $2.{{n}_{{{O}_{2}}}}=2.{{n}_{C{{O}_{2}}}}+{{n}_{{{H}_{2}}O}}=>\text{ }{{n}_{{{O}_{2}}}}=0,375\text{ }mol$
=> V = 8,4 lít
Cho 28,2 gam hỗn hợp X gồm 3 ankin đồng đẳng kế tiếp qua một lượng dư H2 (to, Ni) để phản ứng xảy ra hoàn toàn. Sau phản ứng thể tích thể tích khí H2 giảm 26,88 lít (đktc). CTPT của 3 ankin là
- Ta có: số mol khí giảm = số mol H2 tham gia phản ứng = 1,2
=> tổng số mol hỗn hợp = 1,2 / 2 = 0,6
=> \(\overline M \) = 28,2 / 0,6 = 47
=> \(\overline n \) = 3,5
=> Hỗn hợp có thể là C2H2, C3H4, C4H6 hoặc C3H4, C4H6, C5H8
Hỗn hợp X gồm 3 khí C3H4, C2H2 và H2 cho vào bình kín dung tích 8,96 lít (đktc) chứa bột Ni, nung nóng bình một thời gian thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là:
nX = 0,4 mol
Ta có: \({d_{X/Y}} = \frac{{{{\overline M }_X}}}{{{{\overline M }_Y}}} = \frac{{{n_Y}}}{{{n_X}}} = \frac{{{n_Y}}}{{0,4}} = 0,75 \Rightarrow {n_Y} = 0,3{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} (mol)\)
=> \({n_{{H_2}}}\)phản ứng = ngiảm = nX – nY = 0,4 – 0,3 = 0,1 mol
Hỗn hợp X gồm ankin B và H2 có tỉ khối hơi so với CH4 là 0,6. Nung X với Ni xúc tác để phản ứng xảy ra hoàn toàn thu được hỗn hợp Y có tỉ khối hơi so với CH4 là 1. Cho Y qua dung dịch Br2 dư thì khối lượng bình đựng sẽ:
Do phản ứng hoàn toàn, mà \({\overline M _Y}\)= 1.16 = 16 => H2 dư => ankin phản ứng hết, Y chỉ chứa ankan và H2 dư
Khối lượng bình brom tăng chính là khối lượng của hiđrocacbon không no => Bình không tăng
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + m
=> 0,06.26 + 0,04.2 = m + 0,02.0,5.32
=> m = 1,32 gam
Hỗn hợp X gồm 0,1 mol C2H2, 0,15 mol C2H4, 0,2 mol C2H6 và 0,3 mol H2. Đun nóng với Ni xúc tác một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được số gam CO2 và H2O lần lượt là:
Đốt cháy Y cũng chính là đốt cháy X
- Bảo toàn nguyên tố C: nCO2 = 2.nC2H2 + 2.nC2H4 + 2.nC2H6 = 2.0,1 + 2.0,15 + 2.0,2 = 0,9 mol
=> mCO2 = 39,6 gam
- Bảo toàn nguyên tố H: nH2O = nC2H2 + 2.nC2H4 + 3.nC2H6 + nH2 = 1,3 mol => mH2O = 23,4 gam
Đun nóng m gam hỗn hợp X gồm C2H2, C2H4, Và H2 với xúc tác Ni đến phản ứng xảy ra hoàn toàn, thu được 8,96 lít (đktc) hỗn hợp Y (có tỉ khối so với H2 bằng 8). Đốt cháy hoàn toàn cùng lượng hỗn hợp X trên, rồi cho sản phẩm cháy hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa tạo thành là
nY = 0,4 mol
${\overline M _Y}$= 8.2 = 16 => Y chứa H2 dư
Vì phản ứng xảy ra hoàn toàn nên trong Y chứa C2H6 (a mol) và H2 dư (b mol)
=> a + b = 0,4 mol (1)
${\overline M _Y} = \frac{{30a + 2b}}{{a + b}} = 16$ (2)
Từ (1) và (2) => a = b = 0,2 mol
Đốt cháy X cũng thu được số mol CO2 và H2O như đốt cháy Y
Bảo toàn nguyên tố C: nCO2 = 2.nC2H6 = 2.0,2 = 0,4 mol
=> mCaCO3 = 0,4.100 = 40 gam

