Cho sơ đồ
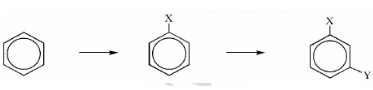
Nhóm X, Y phù hợp sơ đồ trên là
Vì Y nằm ở vị trí meta so với X
Nên X phải là nhóm hút electron để các nhóm thế tiếp theo thế vào vị trí meta.
=> X là -NO2 => Y là -CH3
\({C_2}{H_2} \to A \to B \to m - b{\rm{r}}omben{\rm{z}}en\). A và B lần lượt là

\({C_2}{H_2} \to A \to B \to o - b{\rm{r}}omnit{\rm{r}}oben{\rm{z}}en\). Công thức của A và B lần lượt là

Tính chất nào không phải của toluen?
Nếu không có xúc tác thì toluen không tham gia phản ứng với dung dịch Br2
C6H5CH3 + Br2 Fe,t°−−→→Fe,t° o- Br-C6H4CH3( p- Br-C6H4CH3) + HBr
C6H5CH3 + Cl2 askt−→→asktC6H5CH2Cl + HCl
C6H5CH3 + 2KMnO4 t°→→t°C6H5COOK + 2MnO2 + KOH + H2O
1 mol toluen + 1 mol Cl2 A. A là
Xúc tác là ánh sáng do đó phản ứng thế xảy ả ở nhánh và chỉ có 1 sản phẩm thế.
C6H5CH3 + Cl2 \(\xrightarrow{a\,s\,\,1:\,\,1}\)C6H5CH2Cl + HCl
Phản ứng nào sau đây không dùng để điều chế benzen?
Tam hợp etilen không sinh ra sản phẩm là benzen.
Cho 100 ml benzen (d = 0,879 g/ml) tác dụng với một lượng vừa đủ brom lỏng (xúc tác bột Fe, đun nóng) thu được 80 ml brombenzen (d = 1,495 g/ml). Hiệu suất brom hóa đạt
\(\begin{array}{l}{n_{{C_6}{H_6}}} = \dfrac{{100.0,879}}{{78}} = 1,127(mol)\\{n_{{C_6}{H_5}Br}} = \dfrac{{80.1,495}}{{157}} = 0,762(mol)\\ \to H = \dfrac{{0,762}}{{1,127}}.100\% = 67,6\% \end{array}\)
Nitro hóa benzen thu được 14,1 gam hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC. Đốt cháy hoàn toàn hỗn hợp hai chất nitro này được 0,07 mol N2. Hai chất nitro đó là
C6H6 + nHNO3 → C6H6-n(NO2)n + nH2O
C6H6-n(NO2)n → ½ nN2
Mol: \(\frac{{0,14}}{n}\) ← 0,07
\(M = 78 + 45n = \dfrac{{14,1n}}{{0,14}} \to n = 1,4\)
Phân tử khối hơn kém 45u → hơn kém nhau 1 nhóm -NO2
→ C6H5NO2 và C6H4(NO2)2
A là dẫn xuất benzen có công thức nguyên (CH)n. 1 mol A cộng tối đa 4 mol H2 hoặc 1 mol Br2 (dd). Vậy A là
1 mol A cộng tối đa 4 mol H2 → Trong A có 4 liên kết π
1 mol A cộng tối đa 1 mol Br2 (dd) → Trong A có 1 liên kết π ở nhánh.
→ A là vinylbenzen C6H5-CH=CH2
Đề hiđro hóa etylbenzen ta được stiren, trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polistiren là
\(\begin{array}{l}{C_6}{H_5}{C_2}{H_5} \to {C_6}{H_5}CH = C{H_2} \to \dfrac{1}{n}{\rm{ }}{\left( {CH\left( {{C_6}{H_5}} \right) - C{H_2} - } \right)_n}\\{n_{polistiren}} = \dfrac{{10,4}}{{104n}}{.10^3} = \dfrac{{100}}{n}(mol)\\ \to {n_{etylbenzen(pu)}} = n.{n_{polistiren}} = 100(mol)\\ \to {m_{etylbenzen(bd)}} = \dfrac{{100.106}}{{80\% }} = 13,{25.10^3}(g)\end{array}\)
Thể tích không khí (đktc) cần dùng để đốt cháy hoàn toàn 0,1 mol benzen là (biết trong không khí O2 chiếm 20% thể tích)
C6H6 + \(\frac{{15}}{2}\)O2 \(\xrightarrow{{{t}^{0}}}\) 6CO2 + 3 H2O
Mol 0,1 → 0,75
\( \to {V_{kk}} = \dfrac{{{V_{{O_2}}}}}{{20\% }} = \dfrac{{0,75.22,4}}{{20\% }} = 84(lit)\)
1,3 gam chất hữu cơ A cháy hoàn toàn thu được 4,4 gam CO2 và 0,9 gam H2O. Tỷ khối hơi của A đối với oxi là d thỏa mãn điều kiện 3 < d < 3,5. Công thức phân tử của A là
\({n_{C{O_2}}} = 0,1(mol);{n_{{H_2}O}} = 0,05(mol)\)
=> \({m_O} = 1,3 - 0,1.12 - 2.0,05 = 0(gam)\)
=> A là hidrocacbon.
C : H = 1:1 => gọi CT của A là (CH)n
\(3 < {d_{A/{O_2}}} < 3,5 \to 96 < {M_A} < 112\)
=> 96 < 13n < 112
=> 7,4 < n < 8,6 => n = 8
=> CTPT của A là C8H8
Đốt cháy hết 9,18 gam 2 đồng đẳng kế tiếp thuộc dãy của benzen A, B thu được H2O và 30,36 gam CO2, Công thức phân tử của A và B lần lượt là
Gọi CTPT chung là \({C_{\overline n }}{H_{2\overline n - 6}}\)
\(\begin{array}{l}{n_{C{O_2}}} = 0,69(mol) \to {n_{{C_{\overline n }}{H_{2\overline n - 6}}}} = \dfrac{{{n_{C{O_2}}}}}{{\overline n }} = \dfrac{{0,69}}{{\overline n }}\\M = 14\overline n - 6 = \dfrac{{9,18\overline n }}{{0,69}} \to \overline n = 8,6\end{array}\)
=> CTPT của A và B là C8H10 và C9H12
A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch trong bình tăng hay giảm bao nhiêu gam?
\(\% C:\% H = 92,3\% :7,7\% \to {n_C}:{n_H} = 1:1\)
=> CTPT đơn giản nhất là (CH)n
Tỉ lệ số mol là 1:2:3, từ A có thể điều chế B hoặc C bằng 1 phản ứng; C khống làm mất màu nước brom
=> A là C2H2, B là C4H4, C là C6H6
Đốt 0,1 mol C4H4
\(\begin{array}{l} \to \left\{ \begin{array}{l}{n_{C{O_2}}} = 4{n_B} = 0,4(mol)\\{n_{{H_2}O}} = 2{n_B} = 0,2(mol)\end{array} \right.\\ \to {m_{C{O_2}}} + {m_{{H_2}O}} = 21,2(gam)\\{m_{CaC{O_3}}} = 0,4.100 = 40(gam)\end{array}\)
Khối lượng dung dịch trong bình giảm \( = {m_{CaC{O_3}}} - ({m_{C{O_2}}} + {m_{{H_2}O}}) = 18,8(gam)\)
Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá :
Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá : sp2
Trong phân tử benzen có:
Trong phân tử benzen có: 6 nguyên tử H và 6 nguyên tử C đều nằm trên 1 mặt phẳng
Cho các công thức :
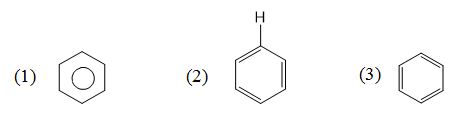
Công thức cấu tạo nào là của benzen ?
Các cấu tạo của benzen là (1) ; (2) và (3).
Ankylbenzen là hiđrocacbon có chứa
Ankylbenzen là hiđrocacbon có chứa gốc ankyl và một vòng benzen.
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là:
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là : CnH2n-6 (n ≥ 6).
Trong các câu sau, câu nào sai ?
Câu sai là: Chất có CTPT C6H6 phải là benzen vì C6H6 có thể là mạch thẳng không no

