Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
Quy hỗn hợp X chứa hai chất: FeO x mol và Fe2O3 y mol
Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2
CO2 + Ca(OH)2 dư → CaCO3 + H2O
Ta có: nCO2 = nCaCO3 = 0,04 mol
Cho Y + H2SO4 đặc nóng dư thu được nSO2 = 0,045 mol
- QT cho e:
FeO → Fe+3 + 1e
x → x mol
C +2 → C+4 + 2e
0,04 0,08 mol
- QT nhận e:
S +6 + 2e → SO2
0,09 ← 0,045 mol
Theo định luật bảo toàn electron: ne cho = ne nhận → x + 0,08 = 0,09 → x = 0,01 mol
Muối thu được sau phản ứng là Fe2(SO4)3 → nFe2(SO4)3 = 18/400 = 0,045 mol
Bảo toàn nguyên tố Fe ta có: nFeO + 2nFe2O3 = 2nFe2(SO4)3 => x + 2y = 0,045.2 → y = 0,04 mol
→ m = mFeO + mFe2O3 = 72x + 160y = 72.0,01 + 160.0,04 = 7,12 gam
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Ta có PTHH:
C + H2O → CO + H2 (1)
C + 2H2O → CO2 + 2H2(2)
Từ (1) và (2) => n C phản ứng = nY - nX = 0,4 (mol)
Áp dụng định luật bảo toàn electron
=> 4 * nC = 2* nH2 + 2 * nCO
=> nH2 + nCO = 0,8 (mol)
Mà nY = 0,95 mol => nCO2 (trong Y) = 0,95 - 0,8 = 0,15 (mol)
Ta có n Ba(OH)2 = 0,1
=> T = nOH/nCO2 = 0,2 : 0,15 = 1,3333
=> Sau phản ứng sinh ra 2 muối là Ba(HCO3)2 và BaCO3
Gọi số mol Ba(HCO3)2 và BaCO3 là x, y (mol)
Áp dụng định luật bảo toàn Ba => x + y = 0,1 (I)
Áp dụng định luật bảo toàn C => 2x + y = 0,15 (II)
=> x = 0,05; y = 0,05
=> n BaCO3 = 0,05 (mol)
=> m BaCO3 = 9,85 gam
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe2O3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
\(a(mol)X\left\{ \begin{array}{l}{H_2}O\\C{O_2}\end{array} \right. + C \to 1,8a(mol)Y\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right. + {\rm{\{ }}CuO,F{e_2}{O_3}{\rm{\} du}} \to {{\rm{m}}_{{\rm{ran}}\,giam}} = 1,28(g)\)
Nhận thấy, C là nguyên nhân làm cho số mol hỗn hợp khí tăng lên => nC = 1,8a - a = 0,8a mol
Sau khi cho Y tác dụng với Fe2O3, CuO dư tạo thành H2O, CO2 nên ta có thể coi hỗn hợp Y gồm {H2O, CO2, C} như vậy ta thấy chỉ có C có phản ứng: C + 2O → CO2
=> nO(pư) = 2nC = 2.0,8a = 1,6a mol
m chất rắn giảm = mO pư => nO pư = 1,6a = 1,28/16 => a = 0,05
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
\(CO\,du + \left\{ \matrix{
CuO \hfill \cr
A{l_2}{O_3} \hfill \cr
CaO \hfill \cr
MgO \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow A\left\{ \matrix{
Cu \hfill \cr
A{l_2}{O_3} \hfill \cr
CaO \hfill \cr
MgO \hfill \cr} \right.\buildrel { + {H_2}O\,du} \over
\longrightarrow \left\langle \matrix{
dd:Ca{(Al{O_2})_2} \hfill \cr
X\left\{ \matrix{
Cu \hfill \cr
MgO \hfill \cr} \right. \hfill \cr} \right.\)
CO + Cu \(\buildrel {{t^0}} \over\longrightarrow \)Cu + H2O
CaO + H2O → Ca(OH)2
Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O
Vì các chất ban đầu có cùng số mol nên Al2O3 phản ứng hết với dd Ca(OH)2.
Do vậy chất rắn sau phản ứng chỉ có Cu và MgO
Cho một luồng khí CO đi qua ống đựng 10g Fe2O3 nung nóng.Sau một thời gian thu được m gam hổn hợp X gồm 3 oxit sắt. Cho X tác dụng hết với dd HNO3 0,5M (vừa đủ) thu được dd Y và 1,12 lít NO (đktc) duy nhất. Thể tích CO đã dùng (đktc) và giá trị của m là
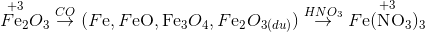
Trong cả quá trình chỉ có C và N thay đổi số oxi hóa
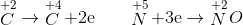
x 2x 0,15 0,05
ĐL bảo toàn e: ne cho = ne nhận => 2x=0,15 => x=0,075
=> VCO = 0,075.22,4=1,68 lít
mchất rắn = m = moxit - mO = 10- 0,075.16 = 8,8 gam

