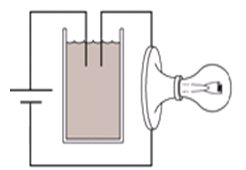
Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
Các dung dịch có khả năng dẫn điện là các dung dịch tan trong nước phân li ra các ion
Đó là : NaCl; CaO; SO3; CH3COOH; Al2(SO4)3
CaO và SO3 tan vào nước xảy ra phản ứng:
CaO + H2O → Ca(OH)2 ; dd Ca(OH)2 thu được là bazo mạnh nên dẫn được điện
SO3 + H2O → H2SO4; dd H2SO4 thu được là axit mạnh nên dẫn được điện
Nồng độ mol của cation và anion trong dung dịch Ba(NO3)2 0,02 M là:
Ba(NO3)2 $\xrightarrow{{}}B{a^{2 + }} + 2N{O_3}^ - $
$[B{a^{2 + }}] = 0,02M$; [NO3−]= 2. 0,02= 0,04M
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
- C2H5OH tan trong nước nhưng không phân li ra ion=>không có khả năng dẫn điện.
- CH3COOH là chất điện li yếu =>dẫn điện yếu hơn so với 2 muối
Cùng nồng độ 0,1 mol/l thì: NaCl →Na+ +Cl− ; K2SO4 →2K+ + SO42−
K2SO4 phân li ra nhiều ion hơn nên dẫn điện mạnh hơn NaCl.
=> C2H5OH < CH3COOH < NaCl < K2SO4
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
$ - {m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)$
$ = > {\text{ }}{V_{dd}} = {\text{ }}m{\text{ }}:{\text{ }}d{\text{ }} = {\text{ }}50{\text{ }}:{\text{ }}1,12{\text{ }} = \frac{{625}}{{14}}ml$
${n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)$
$ = > {C_{MNaOH}}{\text{ }} = {\text{ }}n{\text{ }}:{\text{ }}{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)$
- NaOH → Na+ + OH−
Theo pt: nNaOH = nOH- = 2.10-3 (mol)
=> Thể tích dd A cần lấy là: V = n: CM = 2.10-3 : 3,36 = 6.10-4 lít = 0,6 ml
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
- nH2SO4 = 0,2(mol)
H2SO4 → 2H+ + SO42-
\({n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 2.0,2 = 0,4(mol)\)
- Ba(OH)2 → Ba2+ + 2OH−
\({n_{Ba{{(OH)}_2}}} = \dfrac{1}{2}{n_{O{H^ - }}} = \dfrac{1}{2}.0,4 = 0,2(mol)\)
\( = > {V_{Ba{{(OH)}_2}}} = n:{C_M} = 0,2:0,5 = 0,4(l)\)
Chất nào sau đây dẫn được điện ?
Glucozo là là chất hữu cơ nên không thể dẫn được điện
NaOH và KCl đều ở trạng thái rắn, khan nên cũng không thể dẫn được điện
Dung dịch chất điện li dẫn điện được là do trong dung dịch có chứa:
Các chất điện li khi hòa tan vào nước phân li ra các ion (+) và (-) chuyển động tự do nên dẫn điện được.
Câu nào sau đây đúng khi nói về sự điện li?
Sự điện li là sự phân li một chất thành ion khi tan trong nước hay ở trạng thái nóng chảy.
Chọn câu đúng:
A sai vì hợp chất cộng hóa trị cũng có thể bị phân ly khi hòa tan trong nước, ví dụ như HCl,...
B sai vì độ điện ly phụ thuộc vào nhiệt độ, nồng độ dung dịch, bản chất của chất tan và dung môi.
C sai vì chất điện ly yếu phân ly không hoàn toàn thành ion nên độ điện ly luôn nhỏ hơn 1 và lớn hơn 0.
D đúng.
Khi pha loãng dd axit axetic, không thay đổi nhiệt độ, thấy độ điện li của nó tăng. Ý kiến nào sau đây là đúng?
Ka là hằng số phân ly axit. Giá trị Ka chỉ phụ thuộc vào bản chất axit và nhiệt độ.
Nhiệt độ không đổi và vẫn axit đó nên Ka không thay đổi.
Các dung dịch sau đây có cùng nồng độ 0,10 mol/lít, dung dịch có độ dẫn điện nhỏ nhất là:
CH3COOH là chất điện li yếu.
KCl, CH3COOK, HCl là chất điện ly mạnh phân ly hoàn toàn.
Dung dịch BaCl2 2M có nồng độ mol/l của anion là
Theo định luật bảo toàn nguyên tố:
\({n_{C{l^ - }}} = 2{n_{BaC{l_2}}}\)
Mặt khác BaCl2 là chất điện li mạnh, phân li hoàn toàn thành các ion => [Cl-] = 2.CM dd BaCl2 = 4M
Cho 500 ml dung dịch NaOH 0,2M; NaAlO2 0,1M vào 500 ml dung dịch Ba(OH)2 0,1M; Ba(AlO2)2 0,1M thu được dung dịch A. Nồng độ ion OH- và AlO2- trong dung dịch A lần lượt là
nNaOH = 0,5.0,2 = 0,1 mol; nNaAlO2 = 0,5.0,1 = 0,05 mol
nBa(OH)2 = 0,5.0,1 = 0,05 mol; nBa(AlO2)2 = 0,5.0,1 = 0,05 mol.
Các chất đều là chất điện li mạnh nên điện li hoàn toàn thành ion.
Vậy trong dung dịch A:
nOH- = nNaOH + 2nBa(OH)2 = 0,1 + 2.0,05 = 0,2 mol ⟹ [OH-] = 0,2/1 = 0,2M
nAlO2- = nNaAlO2 + 2nBa(AlO2)2 = 0,05 + 2.0,05 = 0,15 mol ⟹ [AlO2-] = 0,15/1 = 0,15M
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
\({m_{{\rm{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)\)
\( \to {V_{dd}} = m:d = 50:1,12 = \frac{{625}}{{14}}ml\)
\({n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)\)
\( \to {C_{MNaOH}} = n:{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)\)
NaOH → Na+ + OH−
Theo pt: nNaOH = nOH- = 2.10-3 (mol)
⟹ Thể tích dd A cần lấy là: V = n : CM = 2.10-3 : 3,36 = 6.10-4 (l) = 0,6 (ml)
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Khi pha loãng dung dịch 100 lần thì nồng độ các ion trong dung dịch cũng giảm 100 lần
HCl→H+ + Cl−
Trước khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 0,01M$$
Sau khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 1,{0.10^{ - 4}}M$$
Cho các chất sau tan trong nước: Na2CO3, CH3COOCH3, HCOOH, MgCl2, HF. Số chất điện li mạnh và điện li yếu lần lượt là:
- Chất điện li mạnh:
Na2CO3 → 2Na+ + CO32-
MgCl2 → Mg2+ + 2Cl-
- Chất điện li yếu:
HCOOH ⇄ HCOO- + H+
HF ⇄ H+ + F-
- Chất không điện li: CH3COOCH3
Cho các nhận xét sau:
(1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối.
(2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu.
(3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
(4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-.
Số nhận xét đúng là?
(1) đúng
(2) đúng
(3) sai. VD: (NH4)2CO3 là muối điện li ra ion NH4+ không phải là ion kim loại.
(4) sai vì nước cất không dẫn điện
→ Vậy có 2 nhận xét đúng
Tiến hành thí nghiệm như hình vẽ:
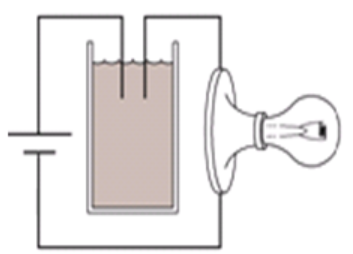
Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào?
+ Khi CO2 vào thì ban đầu nước vôi trong dư so với CO2 nên ion Ca2+ dần đến hết vì bị kết tủa thành CaCO3
⟹ lượng ion trong dung dịch giảm dần về 0
+ Khi CO2 dư thì kết tủa lại bị hòa tan, tạo thành ion Ca2+ và HCO3-
⟹ lượng ion tăng dần
Vậy đèn có độ sáng giảm dần đến tắt rồi lại sáng tăng dần.
Đáp án A
Kết luận nào sau đây không đúng?
A, B, C đúng
D sai vì chất điện li mạnh là chất khi tan trong nước phân li hoàn toàn thành ion
Dung dịch amoniac trong nước có chứa các ion nào sau đây (bỏ qua sự phân li của nước) :
NH4OH → NH4+ + OH-