Thí nghiệm xác định định tính nguyên tố cacbon và hiđro trong phân tử saccarozơ được tiến hành theo các bước sau:
Bước 1: Trộn đều khoảng 0,2 gam saccarozơ với 1 đến 2 gam đồng(II) oxit, sau đó cho hỗn hợp vào ống nghiệm khô (ống số 1) rồi thêm tiếp khoảng 1 gam đồng(II) oxit để phủ kín hỗn hợp. Nhồi một nhúm bông có rắc bột CuSO4, khan vào phần trên ống số 1 rồi nút bằng nút cao su có ống dẫn khí.
Bước 2: Lắp ống số 1 lên giá thí nghiệm rồi nhúng ống dẫn khí vào dung dịch Ca(OH) đựng trong ống nghiệm (ống số 2).
Bước 3: Dùng đèn cồn đun nóng ống số 1 (lúc đầu đun nhẹ, sau đó đun tập trung vào phần có hỗn hợp phản ứng).
Cho các phát biểu sau:
(a) CuSO4 khan được dùng để nhận biết H2O sinh ra trong thí nghiệm.
(b) Thí nghiệm trên, trong ống số 2 có xuất hiện kết tủa trắng.
(c) Ở bước 2, lắp ống số 1 sao cho miệng ống hướng lên.
(d) Thí nghiệm trên còn được dùng để xác định định tính nguyên tố oxi trong phân tử saccarozơ.
(e) Kết thúc thí nghiệm: tắt đèn cồn, để ống số 1 nguội hẳn rồi mới đưa ống dẫn khí ra khỏi dung dịch trong ống số 2.
Số phát biểu đúng là
(a) đúng, nguyên tố H trong saccarozo chuyển hoá thành H2O nên màu trắng của CuSO4 khan chuyển thành màu xanh của CuSO4.5H2O.
(b) đúng, PTHH: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O.
(c) sai, đặt ống nghiệm nằm ngang trên giá ống nghiệm để hơi nước và CO2 thoát ra ống dẫn khí.
(d) sai, thí nghiệm chỉ xác định định tính được C và H.
(e) sai, tháo ống dẫn khí trước khi tắt đèn cồn để tránh dung dịch trong ống 2 bị hút vào ống dẫn khí do áp suất trong ống 1 giảm.
Vậy có 2 phát biểu đúng.
Khoảng giữa tháng 12 năm 2019, dịch viêm phổi cấp COVID-19 do chủng virus corona mới đã bùng phát tại thành phố Vũ Hán, thuộc tỉnh Hồ Bắc ở miền trung Trung Quốc. Triệu chứng của bệnh bao gồm sốt, ho, khó thở,… và có thể gây tử vong cho con người. Trong thời gian dịch bệnh diễn biến phức tạp, Bộ Y tế Việt Nam đã đưa ra các khuyến cáo phòng dịch trong đó có việc sử dụng nước rửa tay khô. Thành phần chính của nước rửa tay khô là cồn y tế (ancol etylic). Trong đó, một số loại nước rửa tay khô được bổ sung thêm chất X giúp làn da mịn màng, tươi trẻ, hạn chế nếp nhăn. Biết đốt cháy 9,89 gam X cần dùng 20,8656 lít khí O2 (đktc) thu được CO2 và H2O. Hấp thụ sản phẩm cháy vào dung dịch Ba(OH)2 dư thấy khối lượng dung dịch giảm 91,701 gam. X có công thức phân tử trùng với công thức đơn giản nhất. Công thức phân tử của X là (biết NTK: H = 1; C = 12; O = 16)
Bước 1: Tính số mol O2 phản ứng
Ta có: \({n_{{O_2}}} = \dfrac{{20,8656}}{{22,4}} = 0,9315\left({mol} \right)\)
Bước 2: Tính số mol CO2 và H2O tạo thành
Đặt số mol của CO2 và H2O lần lượt là a và b (mol)
- BTKL: \({m_{C{O_2}}} + {m_{{H_2}O}} = {m_X} + {m_{{O_2}}}\)
⇔ 44a + 18b = 9,89 + 0,9315.32 = 39,698 (1)
- Khi hấp thụ sản phẩm cháy vào bình đựng Ba(OH)2 dư có phản ứng:
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
Theo PTHH → \({n_{BaC{{\rm{O}}_3}}} = {n_{C{O_2}}} = a\left({mol} \right)\)
Mặt khác, khối lượng dung dịch giảm: mdd giảm = \({m_{BaC{{\rm{O}}_3}}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\)
⇔ 197a - (44a + 18b) = 91,701 ⇔ 153a - 18b = 91,701 (2)
Giải hệ (1) (2) ta được a = 0,667 và b = 0,575.
Bước 3: Tìm CTPT của X
- Bảo toàn nguyên tố C → \({n_C} = {n_{C{O_2}}} = 0,667\left({mol} \right) \to {m_C} = 0,667.12 = 8,004\left(g \right)\)
- Bảo toàn nguyên tố H → \({n_H} = 2{n_{{H_2}O}} = 1,15\left({mol} \right) \to {m_H} = 1,15.1 = 1,15\left(g \right)\)
- Ta thấy mC + mH = 8,004 + 1,15 = 9,154 gam < mX
→ Trong X có chứa Oxi
=> mO = mX - mC - mH = 9,89 - 9,154 = 0,736 gam → nO = 0,046 mol
- Gọi công thức phân tử của X là CxHyOz.
Ta có: x : y : z = nC : nH : nO = 0,667 : 1,15 : 0,046 = 29 : 50 : 2.
Theo đề bài X có CTPT trùng với CTĐGN nên CTPT của X là C29H50O2.
Mentol là chất tự nhiên có trong tinh dầu bạc hà, tạo cảm giác mát khi bôi lên da hoặc các mô trong khoang miệng. Khi phân tích thành phần mentol cho thấy tỉ lệ về khối lượng của cacbon, oxi và hiđro lần lượt là 2,1 : 0,28 : 0,35. Biết mentol có công thức phân tử trùng với công thức đơn giản nhất. Công thức phân tử của mentol là
Gọi công thức đơn giản nhất của mentol là CxHyOz (x,y, z € N*)
Giả sử khối lượng của cacbon, oxi và hiđro lần lượt là 2,1 ; 0,28 và 0,35 gam.
⟹ \(x:y:z = \dfrac{{{m_C}}}{{12}}:\dfrac{{{m_H}}}{1}:\dfrac{{{m_O}}}{{16}} = \dfrac{{2,1}}{{12}}:\dfrac{{0,35}}{1}:\dfrac{{0,28}}{{16}} = 10:20:1\)
⟹ Công thức đơn giản nhất của mentol là C10H20O.
Vì công thức phân tử trùng với công thức đơn giản nhất nên công thức phân tử của mentol là C10H20O.
Từ tinh dầu hồi, người ta tách được anetol - một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148,0 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,10% (về khối lượng) còn lại là oxi. Công thức phân tử của anetol là (biết H = 1, C = 12, O = 16)
Bước 1: Tìm CTĐGN
Gọi CTPT của anetol là CxHyOz (x, y, z ∈ N*)
Phần trăm khối lượng của O trong anetol là: %O = 100% - %C - %H = 100% - 81,08% - 8,10% = 10,82%
Ta có:
\(x:y:z = \dfrac{{\% C}}{{12}}:\dfrac{{\% H}}{1}:\dfrac{{\% O}}{{16}} = \dfrac{{81,08}}{{12}}:\dfrac{{8,1}}{1}:\dfrac{{10,82}}{{16}} = 10:12:1\)
⟹ CTĐGN là C10H12O
Bước 2: Biện luận tìm CTPT
Đặt CTPT của anetol là (C10H12O)n ⟹ Manetol = 148n = 148 ⟹ n = 1
Vậy CTPT của anetol là C10H12O.
Ma túy đá hay còn gọi là hàng đá, chấm đá là tên gọi chỉ chung cho các loại ma túy tổng hợp, có chứa chất Methamphetamine (Meth). Những người thường xuyên sử dụng ma túy gây ra hậu quả là suy kiệt thể chất, hoang tưởng, thậm chí mất kiểm soát hành vi, chém giết người vô cớ, nặng hơn sẽ mắc tâm thần. Khi oxi hóa hoàn toàn 104,3 gam Meth bằng CuO dư, dẫn sản phẩm cháy lần lượt qua bình 1 đựng dung dịch H2SO4 đặc, bình 2 đựng dung dịch Ba(OH)2 dư. Sau khi kết thúc thí nghiệm thấy khối lượng bình 1 tăng 94,5 gam, ở bình 2 tạo thành 1379 gam kết tủa và còn 7,84 lít khí (đktc) thoát ra. Biết Meth có công thức phân tử trùng với công thức đơn giản nhất. Công thức phân tử của Meth là
Bước 1: Tính số mol CO2, H2O, N2
Phản ứng oxi hóa hoàn toàn bằng CuO tương đương như việc đốt cháy bằng O2.
- Khối lượng bình 1 tăng là khối lượng của H2O ⟹ \({n_{{H_2}O}} = \dfrac{{94,5}}{{18}} = 5,25(mol)\)
- Do Ba(OH)2 dư ⟹ \({n_{C{O_2}}} = {n_{BaC{O_3}}} = \dfrac{{1379}}{{197}} = 7(mol)\)
- Khí thoát ra là N2 ⟹ \({n_{{N_2}}} = \dfrac{{7,84}}{{22,4}} = 0,35(mol)\)
Bước 2: Xác định thành phần các nguyên tố có trong Meth
- Bảo toàn C ⟹ \({n_C} = {n_{C{O_2}}} = 7(mol)\)
- Bảo toàn H ⟹ \({n_H} = 2{n_{{H_2}O}} = 2.5,25 = 10,5(mol)\)
- Bảo toàn N ⟹ \({n_N} = 2{n_{{N_2}}} = 2.0,35 = 0,7(mol)\)
- Nhận thấy: \({m_C} + {m_H} + {m_N} = 7.12 + 10,5 + 0,7.14 = 104,3 = {m_{Meth}}\)
⟹ Meth chỉ chứa C, H và N, không chứa O.
Bước 3: Xác định Meth
Gọi CTĐGN của Meth là CxHyNz
Ta có \(x:y:z = {n_C}:{n_H}:{n_N} = 7:10,5:0,7 = 10:15:1\)
⟹ CTĐGN của Meth là C10H15N.
Do Meth có CTPT trùng CTĐGN ⟹ CTPT của Meth là C10H15N.
Nicotin là chất độc gây nghiện có nhiều trong cây thuốc lá. Khói thuốc lá có rất nhiều chất độc không những gây hại cho người hút mà còn ảnh hưởng đến những người xung quanh gây ra các bệnh hiểm nghèo như ung thư phổi, ung thư vòm họng,… Thành phần phần trăm khối lượng các nguyên tố trong Nicotin lần lượt như sau: 74,07%C, 17,28%N, 8,64% H. Tỉ số khối hơi của Nicotin so với Heli là 40,5. Cho H = 1; He = 4; C = 12; N = 14; O = 16. Công thức phân tử của Nicotin là
- Xét thành phần phần trăm khối lượng các nguyên tố ta có:
\({n_C}:{n_H}:{n_N} = \dfrac{{\% {m_C}}}{{12}}:\dfrac{{\% {m_H}}}{1}:\dfrac{{\% {m_N}}}{{14}} = \dfrac{{74,07\% }}{{12}}:\dfrac{{8,64\% }}{1}:\dfrac{{17,28\% }}{{14}} = 5:7:1\)
⟹ Công thức đơn giản nhất của Nicotin là C5H7N.
⟹ CTPT của Nicotin có dạng là (C5H7N)n.
- Ta có MNicotin = 40,5.4 = 162 = 81n ⟹ n = 2.
Vậy Nicotin có công thức phân tử là C10H14N2.
β-Caroten (chất hữu cơ có trong củ cà rốt) có màu da cam. Nhờ tác dụng của enzim trong ruột non, β-caroten chuyển thành vitamin A nên nó còn được gọi là tiền vitamin A. Oxi hoá hoàn toàn 6,7 gam β-caroten rồi dẫn sản phẩm cháy qua bình (1) đựng dung dịch H2SO4 đặc thấy khối lượng bình (1) tăng 6,3 gam. Sau đó, khí thoát ra được dẫn qua qua bình (2) đựng dung dịch Ca(OH)2 thu được 30,0 gam kết tủa và dung dịch X. Thêm dung dịch KOH 1,0 M vào X, thu được kết tủa. Để lượng kết tủa thu được là lớn nhất thì cần tối thiểu 100,0 ml dung dịch KOH. Công thức đơn giản nhất của β-caroten là
Bước 1: Tính số mol CaCO3 và số mol KOH
- Dẫn sản phẩm cháy qua bình (1) đựng H2SO4 đặc và bình (2) đựng dung dịch Ca(OH)2:
+ Axit H2SO4 đặc có tính háo nước nên hấp thụ nước
⟹ \({m_{{H_2}O}} = {m_{binh(1)\tan g}} = 6,3\left(g \right) \to {n_{{H_2}O}} = \dfrac{{6,3}}{{18}} = 0,35\left({mol} \right)\)
+ Khí thoát ra là CO2, cho hấp thụ vào Ca(OH)2:
Ta có:
\({n_{CaC{{\rm{O}}_3}}} = \dfrac{{30}}{{100}} = 0,3\left({mol} \right);{n_{K{\rm{O}}H}} = 0,1.1 = 0,1\left({mol} \right)\)
Bước 2: Tính số mol Ca(HCO3)2
- Do thêm KOH vào dung dịch X thu được kết tủa
⟹ dung dịch X có chứa Ca(HCO3)2
- Theo đề bài, để lượng kết tủa lớn nhất thì cần lượng tối thiểu KOH nên phản ứng là:
Ca(HCO3)2 + KOH → CaCO3 ↓ + KHCO3 + H2O
0,1 ← 0,1 (mol)
Bước 3: Tính số mol CO2
- Bảo toàn nguyên tố C ⟹ \({n_{C{O_2}}} = {n_{CaC{{\rm{O}}_3}}} + 2{n_{Ca{{(HC{O_3})}_2}}} = 0,3 + 2.0,1 = 0,5\left({mol} \right)\)
Bước 4: Tìm CTĐGN của β-caroten
- Xét phản ứng cháy của β-caroten:
+ Bảo toàn nguyên tố C ⟹ \({n_C} = {n_{C{O_2}}} = 0,5\left({mol} \right)\)
+ Bảo toàn nguyên tố H ⟹ \({n_H} = 2{n_{{H_2}O}} = 2.0,35 = 0,7\left({mol} \right)\)
- Ta thấy: mC + mH = 0,5.12 + 0,7.1 = 6,7 = mβ-caroten ⟹ β-caroten không chứa O
⟹ nC : nH = 0,5 : 0,7 = 5 : 7
Vậy CTĐGN của β-caroten là C5H7.
Metyl salixylat là hợp chất được dùng làm thuốc xoa bóp giảm đau. Oxi hóa hoàn toàn 7,6 gam metyl salixylat rồi dẫn sản phẩm lần lượt qua bình H2SO4 đặc (1) và bình nước vôi trong (2) thấy bình (1) tăng 3,6 gam, bình (2) tăng 17,6 gam. Biết khi hóa hơi 11,4 gam metyl salixylat thì thu được thể tích đúng bằng thể tích của 2,4 gam khí oxi (đo cùng điều kiện). Công thức phân tử của metyl salixylat là (cho NTK: H=1; C=12; O=16)
Bước 1: Tính nH, mH
- Ta có: mbình 1 tăng = mnước \(\to {m_{{H_2}O}} = 3,6\left({gam} \right) \to {n_{{H_2}O}} = \dfrac{{3,6}}{{18}} = 0,2\left({mol} \right)\)
\(\to {n_H} = 2{n_{{H_2}O}} = 2.0,2 = 0,4\left({mol} \right) \to {m_H} = 1.0,4 = 0,4\left({gam} \right)\)
Bước 2: Tính nC, mC
- Ta có: mbình 2 tăng = mCO2 \(\to {m_{C{O_2}}} = 17,6\left({gam} \right) \to {n_{C{O_2}}} = \dfrac{{17,6}}{{44}} = 0,4\left({mol} \right)\)
\(\to {n_C} = {n_{C{O_2}}} = 0,4\left({mol} \right) \to {m_C} = 12.0,4 = 4,8\left({gam} \right)\)
Bước 3: Xác định phân tử có O không
- Vì mC + mH = 4,8 + 0,4 = 5,2 < mmetyl salixylat → trong metyl salixylat có O
\({m_O} = {m_{metylsalixylat}} - {m_C} - {m_H} = 7,6 - 4,8 - 0,4 = 2,4\left({gam} \right) \to {n_O} = \dfrac{{2,4}}{{16}} = 0,15\left({mol} \right)\)
Bước 4: Tìm CTPT
- Gọi công thức phân tử của metyl salixylat là CxHyOz
\(x:y:z = {n_C}:{n_H}:{n_O} = 0,4:0,4:0,15 = 8:8:3\)
Vậy công thức đơn giản nhất của metyl salixylat là C8H8O3.
- Ta có: \({n_{{O_2}}} = \dfrac{{2,4}}{{32}} = 0,075\left({mol} \right)\)
Vì thể tích của metyl salixylat bằng thể tích oxi nên:
\({n_{metylsalixylat}} = {n_{{O_2}}} = 0,075\left({mol} \right)\)
\(\to {M_{metylsal{\rm{ix}}ylat}} = \dfrac{{11,4}}{{0,075}} = 152 \to (8.12 + 8.1 + 3.16)n = 152 \to n = 1\)
Vậy công thức phân tử của metyl salixylat là C8H8O3.
Cho m gam hợp chất hữu cơ no, mạch hở X (phân tử chứa các nhóm – OH, – COO –, – COOH, – CH2 –, không có nhóm chức khác). Cho m gam X tác dụng vừa đủ với 300ml dung dịch NaOH 1M, thu được một sản phẩm hữu cơ Y duy nhất. Đốt cháy hoàn toàn m gam X, thu được 20,16 lít CO2 (đktc) và 12,6 gam H2O. Cho các phát biểu sau:
(a) Khối lượng phân tử của X là 234.
(b) Đốt cháy X, thu được số mol CO2 bằng số mol O2 đã phản ứng.
(c) Y có công thức cấu tạo là HO – CH(CH3) – COONa.
(d) Khối lượng của Y là 33,6 gam.
Số phát biểu đúng là
Bước 1: Tính nX
- Hợp chất hữu cơ X chỉ chứa các nguyên tố C, H, O nên có CTPT là CnH2n+2-2kOx với k là độ bất bão hòa (bằng tổng số vòng và số liên kết $\pi $trong CTCT).
Xét phản ứng đốt cháy của X:
\[{C_n}{H_{2n + 2 - 2k}}{O_x}\,\xrightarrow{{{t^o}}}\,nC{O_2}\, + \,(n + 1 - k){H_2}O\]
- nCO2 = 0,9 mol ; nH2O = 0,7 mol
Gọi nX = a mol:
⟹ nX = $\dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1 - k}}$ ⟹ k – 1 = $\dfrac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{{n_X}}}$
⟹ k = $\dfrac{{0,9 - 0,7}}{a} + 1$
- Vì nNaOH = n-COO- + n-COOH = 0,3, tổng số liên kết $\pi $có trong – COO –, – COOH
⟹ k = $\dfrac{{0,9 - 0,7}}{{0,3/x}} + 1$(x là tổng số nhóm – COO –, – COOH)
- Xét bảng sau:
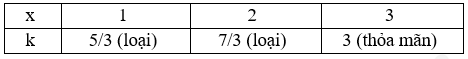
⟹ nX = $\dfrac{{0,3}}{3}$= 0,1
Bước 2: Tìm CTCT của X
- CTCT của X có dạng:
HO – (CH2)a – COO – (CH2)b – COO – (CH2)c – COOH: 0,1 mol
- Vì nCO2 = 0,9 mol
⟹ Số C = $\dfrac{{0,9}}{{0,1}}$= 9
⟹ CTCT của X: HO – (CH2)2 – COO – (CH2)2 – COO – (CH2)2 – COOH
Bước 3: Xét các phát biểu
(a) Phân tử khối của X là 234 ⟹ Đúng
(b) X có CTPT là C9H14O7
⟹ nOxi cần = 0,1.$\left( {9 + \frac{{14}}{4} - \frac{7}{2}} \right)$= 0,9 mol
⟹ ${n_{{O_2}}} = {n_{C{O_2}}}$⟹ Đúng
(c) X + NaOH → Y: HO – (CH2)2 – COONa ⟹ Sai
(d) nY = 0,1.3 = 0,3 mol ⟹ mY = 0,3.112 = 33,6 gam ⟹ Đúng
- Vậy có 3 phát biểu đúng.

