Cho 2 thí nghiệm sau:
Thí nghiệm 1: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M được a lít NO.
Thí nghiệm 2: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M và H2SO4 0,5M được b lít NO.
Biết NO là sản phẩm khử duy nhất của N+5. Mối liên hệ giữa a và b là
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
TN1: nCu = 0,1 mol; nHNO3 = 0,12 mol
Xét \(\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,12}}{8} = 0,015;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\)
=> H+ hết, Cu và NO3- dư => phản ứng tính theo H+
nNO (1) = 1/4.nH+ = 1/4.0,12 = 0,03 mol
TN2: nCu = 0,1 mol; nH+ = 0,24 mol; nNO3- = 0,12 mol
Xét \(\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,24}}{8} = 0,03;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\)
=> H+ hết, Cu và NO3- dư => phản ứng tính theo H+
nNO (2) = 1/4.nH+ = 1/4.0,24 = 0,06 mol
=> nNO (2) = 2.nNO (1) => b = 2a
Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là
Gọi nNO = a mol; nN2O = b mol => nX = a + b = 0,25 mol (1)
\({\bar M_X} = \frac{{30a + 44b}}{{a + b}} = 16,4.2\) (2)
Từ (1) và (2) => a = 0,2; b = 0,05
Giả sử phản ứng tạo ra NH4NO3 x mol
Bảo toàn e: ne cho = ne nhận = 3.nNO + 8.nN2O + 8.nNH4NO3 = 3.0,2 + 8.0,05 + 8a
=> nNO3 (trong muối) = ne cho = 1 + 8a
Bảo toàn nguyên tố N: nHNO3 = nNO + 2.nN2O + nNO3 (trong muối) + 2.nNH4NO3
=> 1,425 = 0,2 + 2.0,05 + 1 + 8a + 2a => a = 0,0125 mol
=> mmuối = mkim loại + mNO3 (trong muối) + mNH4NO3 = 29 + (1 + 8.0,0125).62 + 0,0125.80 = 98,2 gam
Hòa tan hoàn toàn m gam Al bằng 620 ml dung dịch HNO3 1M vừa đủ thu được hỗn hợp khí X ( gồm hai khí) và dung dịch Y chứa 8m gam muối. Cho dung dịch NaOH dư vào Y thấy có 25,84 gam NaOH phản ứng. Hai khí trong X là cặp khí nào sau đây
Al + 0,62 mol HNO3 → Al(NO3)3 + khí X
Nếu muối chỉ có mAl(NO3)3 = < 8m → muối có cả NH4NO3
Al(NO3)3 + 4NaOH → NaAlO2 + NaNO3 + 2H2O
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
Ta có nNaOH = 0,646 = \(\dfrac{m}{{27}}.4 + \dfrac{{8m - 7,89m}}{{80}}\) → m =4,32 g → Al: 0,16 mol và NH4NO3: 0,006 mol
Al → Al+3 + 3e N+5 +8e → N-3
N+5 + (5-x) e → N+X
Bảo toàn e có 3.nAl = 8nNH4 + (5-x).nN(+x) → 0,48 = 8.0,006 + (5-x).nN(+x)
Bảo toàn N có nN(+x) + 2nNH4NO3 + 3nAl = nHNO3 → nN(+x) = 0,62 – 2.0,006 – 3.0,16 = 0,128
→ x = 1,625
A sai vì cả 2 khí N đều có số oxh > 1,625
B sai vì tạo khí H2
C đúng
D sai vì cả 2 khí đều có số oxh nhỏ hơn 1,625
Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol
Có nY = 0,25 = x + y mol
Và mY = MY . nY = 13,6.2.0,25 = 6,8 g = 44x + 2y
Nên x = 0,15 mol và y = 0,1 mol
Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì
4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O
Mg +2H+ → Mg+2 + H2
Ta có 4nN2O + nH2 = 4.0,15 + 0,1 = 0,7 mol < nMg = 0,9 nên phản ứng có tạo ra NH4+ :
4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+
nên nNH4+ = (0,9 – 0,7 ) : 4 =0,05 mol
Bảo toàn nguyên tố N có nNaNO3 = 2nN2O + nNH4 =2.0,15 + 0,05 = 0,35 mol
Bảo toàn nguyên tố H có nNaHSO4 = 10nN2O + 2nH2 + 10nNH4 = 10.0,15 + 0,1.2 + 0,05.10 = 2,2 mol
Sau phản ứng dung dịch X thu được có Mg+2 : 0,9 mol; NH4+ : 0,05 mol; Na+ : 2,55 mol và SO42- : 2,2 mol
=> mmuối = mion = 0,9.24 + 0,05.18 + 2,55.23 + 2,2.96 = 292,35
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4
\( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\)
Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\)
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\)
Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\)
Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\)
\( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
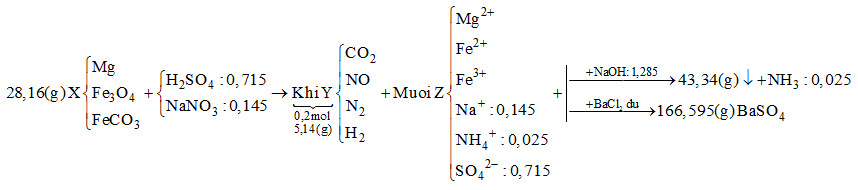
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\)
Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)
\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)
Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)
Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)
\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)
\( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)
Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)
\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)
Đặt số mol của CO2, NO và N2 lần lượt là x, y, z
\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*)
Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)
\( \to 44x + 30y + 28z = 5,04\) (**)
Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)
\( \to y + 2z = 0,12\) (***)
Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04
\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)
Gọi số mol của Mg và Fe3O4 lần lượt là a và b
\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2)
Từ (1) và (2) \( \to \) a = 0,4; b = 0,06
\( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \)
Dung dịch X chứa 0,2 mol Fe(NO3)3 và 0,24 mol HCl. Dung dịch X có thể hòa tan được tối đa bao nhiêu gam Cu (biết phản ứng tạo khí NO là sản phẩm khử duy nhất)
PT ion rút gọn: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
ban đầu: 0,24 0,6 (mol)
pư: 0,09←0,24 →0,06 (mol)
sau: 0,09 0,54 (mol)
PT ion rút gọn: Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,1 ← 0,2 (mol)
=> ∑ nCu = 0,09 + 0,1 = 0,19 (mol)
=> mCu = 0,19.64 = 12,16 (g)
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
X + HNO3 → Muối + NO + H2O
BTKL: mH2O = mX + mHNO3 - m muối - mNO = 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam
=> nH2O = 0,47 mol
BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => 0,98 = 4nNH4+ + 2.0,47 => nNH4+ = 0,01 mol
BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => 0,98 = nNO3- + 0,01 + 0,1 => nNO3- = 0,87 mol
BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O
=> nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 => nO(X) = 0,24 mol
=> m = mKL = mX - mO(X) = 18,6 - 0,24.16 = 14,76 gam
Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
Đặt số mol Al và Fe trong X là x mol thì mX = 27x + 56x = 2,49
→ x = 0,03 mol
+) X + 0,17 mol HCl
2 Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
→ Dd Y thu được có AlCl3: 0,03 mol; FeCl2: 0,03 mol; HCl: 0,02 mol
+) Y + 0,2 mol AgNO3 thì :
3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO
0,015 mol ← 0,02 mol
Ag+ + Cl- → AgCl
0,17 0,17 0,17 (mol)
\(n_{Fe^{2+}}còn\; lại =0,015\) mol
\(n_{Ag^+}còn\; lại = 0,03\) mol
Fe2+ + Ag+ → Fe3+ + Ag
0,015 0,03
=> \(n_{Fe^{2+}}\) phản ứng hết trước
=> \(n_{Fe^{2+}}=n_{Ag}=0,015\) mol
→ mrắn = mAgCl + mAg = 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g
→ gần nhất với 26,0 g
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
A đúng
B loại CuO, CaCO3
C loại CaO
D loại Fe2O3
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2.
=> nNO = nNO2 = 0,3 – 0,2 = 0,1 mol
Áp dụng đường chéo cho hỗn hợp Z:
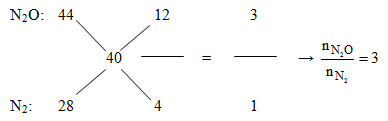
Mà nN2O + nN2 = nZ = 0,2 mol => nN2O = 0,15 và nN2 = 0,05
Đặt: nMg = 4x và nAl = 5x (mol) => nMg(OH)2 = 4x và mAl(OH)3 = 5x
m kết tủa max = mKL + mOH- => m + 39,1 = m + 17(4x.2 + 5x.3) => x = 0,1
=> nMg = 0,4 mol và nAl = 0,5 mol
Ta thấy: 2nMg + 3nAl > 3nNO + 8nN2O + 10nN2 => Có tạo muối NH4NO3
Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3
=> 2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3
=> nNH4NO3 = 0,0375 mol
Công thức tính nhanh: nHNO3 pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol
=> nHNO3 bđ = 2,875 + 2,875.(20/100) = 3,45 mol
=> m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam
m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2
= 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam
Ta có: nAl(NO3)3 = nAl = 0,5 mol
→ %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
A loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với Fe(OH)2 và FeO
B loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeCO3
C đúng
D loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeS
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
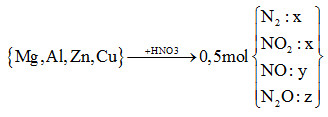
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O
= 12x + 2x + 4y + 10z = 14x + 4y +10z (*)
*nZ = 2x + y + z = 0,5 mol (1)
*mZ = nZ.MZ => 28x + 44x + 30y + 44z = 0,5.8,9.4
=> 74x + 30y + 44z = 17,8 (2)
\(\xrightarrow{{\dfrac{3}{7}(2) - \dfrac{{62}}{7}(1)}}14x + 4y + 10z = 3,2\)(**)
(*) và (**) => nHNO3 = 3,2 mol
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Do Fe dư nên tạo thành muối Fe2+
nFe = (20 – 3,2)/56 = 0,3 mol
BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol
=> V = 4,48 lít
Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là
Chỉ có Cu phản ứng với HNO3 sinh ra khí.
Sử dụng định luật bảo toàn e ta có: 2nCu = nNO2 => nNO2 = 2.0,1 = 0,2 mol
=> V = 4,48 lít
Hòa tan hết 30 gam chất rắn gồm Mg, MgO, MgCO3 trong dung dịch HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ khối so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị m là
Bước 1: Tính nNO và nCO2
- Đặt số mol của NO và CO2 lần lượt là a và b (mol).
+) nkhí = 0,2 mol ⟹ a + b = 0,2
+) mkhí = 0,2.18,5.2 = 7,4 gam ⟹ 30a + 44b = 7,4
Giải hệ trên được a = b = 0,1.
Bước 2: Tính nMg, nMgO, nNH4NO3 tạo thành
- Hỗn hợp ban đầu chứa: Mg (x); MgO (y); MgCO3 (0,1).
Đặt nNH4NO3 = z mol.
+) mhh = 30 gam ⟹ 24x + 40y + 0,1.84 = 30 (1)
+) BTe: 2nMg = 3nNO + 8nNH4NO3 ⟹ 2x = 3.0,1 + 8z (2)
+) Muối chứa Mg(NO3)2 (x + y + 0,1) và NH4NO3 (z)
Bảo toàn nguyên tố N: nHNO3 = 2nMg(NO3)2 + 2nNH4NO3 + nNO
⟹ 2,15 = 2(x + y + 0,1) + 2z + 0,1 (3)
Từ (1)(2)(3) ⟹ x = 0,65; y = 0,15; z = 0,125.
Bước 3: Tính mmuối trong X.
mmuối = mMg(NO3)2 + mNH4NO3 = 143,2 gam.
Hỗn hợp X gồm a mol P và b mol S. Hoà tan hoàn toàn X trong dung dịch HNO3 đặc, nóng lấy dư 20% so với lượng cần phản ứng thu được dung dịch Y và thoát ra khí NO2 (sản phẩm khử duy nhất). Trung hoà dung dịch Y bằng NaOH thì cần bao nhiêu mol?
Cách 1: Viết PTHH
Bước 1: Viết các PTHH của P tác dụng với HNO3 đặc và S tác dụng với HNO3 đặc.
P + 5HNO3 đ \(\xrightarrow{{{t^o}}}\) H3PO4 + 5NO2 + H2O
a → 5a → a (mol)
S + 6HNO3 đ \(\xrightarrow{{{t^o}}}\) H2SO4 + 6NO2 + 2H2O
b → 6b → b (mol)
Bước 2: Tính nHNO3 pứ và nHNO3 dư
- Đặt số mol của P, S là a, b
⟹ nHNO3 pứ = 5a + 6b (mol)
⟹ nHNO3 dư = 20%.nHNO3 pứ = 20%.(5a + 6b) = a + 1,2b (mol)
Bước 3: Xác định thành phần dd Y và viết các PTHH khi trung hòa
- Dung dịch Y gồm \(\left\{ \begin{array}{l}{H_3}P{O_4}:\,\,a\left( {mol} \right)\\{H_2}S{O_4}:b\left( {mol} \right)\\HN{O_3}:a + 1,2b\left( {mol} \right)\end{array} \right.\)
- Các phản ứng xảy ra khi trung hòa:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
HNO3 + NaOH → NaNO3 + H2O
Bước 4: Tính nNaOH
- nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3a + 2b + (a + 1,2b) = 4a + 3,2b (mol)
Cách 2: Sử dụng bảo toàn e
Bước 1: Tính nHNO3 pư và nHNO3 dư
- Đặt số mol của P, S là a, b
- Khi X + HNO3: \(\left\{ \begin{array}{l}P\left( a \right)\\S\left( b \right)\end{array} \right. + HN{O_3} \to \left\{ \begin{array}{l}{H_3}P{O_4}\left( a \right)\\{H_2}S{O_4}\left( b \right)\\HN{O_3}du\end{array} \right. + N{O_2} + {H_2}O\)
- Áp dụng bảo toàn e: 5nP + 6nS = nNO2 = 5a + 6b (mol)
- Bảo toàn nguyên tố N: nHNO3 pư = nNO2 = 5a + 6b (mol)
⟹ nHNO3 dư = 20%.(5a + 6b) = a + 1,2b (mol)
Bước 2: Tính nNaOH
- Khi trung hòa thì nOH- = nH+
⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3.a + 2.b + (a + 1,2b) = 4a + 3,2b (mol).

