Chuẩn độ dung dịch
Kỳ thi ĐGNL ĐHQG Hà Nội
Hoà tan 25 gam hỗn hợp X gồm FeSO4 và Fe2(SO4)3 vào nước, thu được 150 ml dung dịch Y. Thêm H2SO4 (dư) vào 20 ml dung dịch Y rồi chuẩn độ toàn bộ dung dịch này bằng dung dịch KMnO4 0,1M thì dùng hết 30 ml dung dịch chuẩn. Phần trăm khối lượng FeSO4 trong hỗn hợp X là
Bước 1: Tính nFe2+ trong 20 ml dd Y
- nKMnO4 = 0,1.0,03 = 0,003 mol
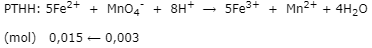
- Trong 20 ml dung dịch Y có 0,015 mol Fe2+
⟹ 150 ml dung dịch Y có x mol nFe2+
⟹ nFe2+ = 0,015.150/20 = 0,1125 mol
Bước 2: Tính %mFeSO4 trong X
- mFeSO4 = 0,1125.152 = 17,1 gam
→ %mFeSO4 = (17,1/25).100% = 68,4%.
Để xác định nồng độ dung dịch NaOH người ta tiến hành như sau: Cân 1,26 gam axit oxalic ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 ml. Lấy 10 ml dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) thì hết 17,5 ml dung dịch NaOH. Tính nồng độ dung dịch NaOH đã dùng.
Bước 1: Tính n(COOH)2 trong 10 ml dung dịch axit oxalic
- \({n_{{H_2}{C_2}{O_4}.2{H_2}O}} = \dfrac{{1,26}}{{90 + 18.2}} = 0,01\left( {mol} \right)\)
- 100 ml dung dịch axit oxalic chứa 0,01 mol (COOH)2
10 ml ⟶ 0,001 mol
Bước 2: Tính nNaOH
- Phenolphtalein xuất hiện màu hồng ở pH = 9 > 7 ⟹ NaOH dư, (COOH)2 hết
- Đặt nNaOH = x mol.
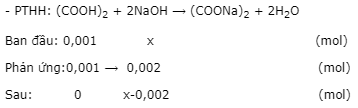
pH = 9 ⟹ pOH = 14 - 9 = 5 ⟹ [OH-]sau pư = 10-5
Bước 3: Tính CM NaOH
- Ta có: \({\left[ {O{H^ - }} \right]_{sau\,pu}} = \dfrac{{x - 0,002}}{{(10 + 17,5){{.10}^{ - 3}}}} = {10^{ - 5}}\) ⟹ x = 2,000275.10-3.
⟹ CM NaOH = \(\dfrac{{{n_{NaOH}}}}{{{V_{dd\,NaOH}}}}\) = \(\dfrac{{2,{{000275.10}^{ - 3}}}}{{17,{{5.10}^{ - 3}}}}\) = 0,1143 M.
Để xác định nồng độ dung dịch NaOH, người ta dùng dung dịch đó chuẩn độ 25,00 ml dung dịch H2C2O4 0,05M (dùng phenolphtalein làm chỉ thị). Khi chuẩn độ dùng hết 46,50 ml dung dịch NaOH. Nồng độ mol của dung dịch NaOH đó là
Bước 1: Tính số mol NaOH
n(COOH)2 = 0,025.0,05 = 0,00125 mol
Bước 2: Tính nồng độ NaOH
PTHH: (COOH)2 + 2NaOH → (COONa)2 + 2H2O
nNaOH = 2n(COOH)2 = 2.0,00125 = 0,0025 (mol)
⟹ CM NaOH = 0,025 : 0,0465 ≈ 0,054M
Nung 0,935 gam quặng cromit với chất oxi hóa để oxi hóa toàn bộ crom thành CrO42-. Hòa tan sản phẩm vào nước, phân hủy hết chất oxi hóa, axit hóa dung dịch bằng H2SO4 rồi thêm 50,0 ml dung dịch FeSO4 0,08M vào. Để chuẩn độ FeSO4 dư cần 14,85 ml dung dịch KMnO4 0,004M. Hàm lượng crom có trong quặng là
Bước 1: Tính nFeSO4, nKMnO4
\({n_{F{{\rm{e}}^{2 + }}\left( {b{\rm{d}}} \right)}} = 0,05.0,08 = 0,004\left( {mol} \right)\)
\({n_{KMn{O_4}}} = 0,01485.0,004 = 5,{94.10^{ - 5}}\left( {mol} \right)\)
Bước 2: Tính nCrO42-
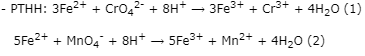
Theo (2) ⟹ nFe2+(dư) = 5.nMnO4- = 5.5,94.10-5 = 2,97.10-4 (mol)
⟹ nFe2+(pư) = 0,004 - 2,97.10-4 = 3,703.10-3 (mol)
Theo (1) ⟹ nCrO42- = 1/3.nFe2+(pư) = 1/3.3,703.10-3 = 1,23433.10-3 (mol)
⟹ mCr = 1,23433.10-3.52 = 0,064 gam.
Bước 3: Tính hàm lượng Crom trong quặng cromit
- %mCr = \(\dfrac{{0,064}}{{0,935}}.100\% \) = 6,845%.
Để xác định nồng độ mol/l của dd K2Cr2O7 người ta làm như sau:
Lấy 10 ml dung dịch K2Cr2O7 cho tác dụng với lượng dư dung dịch KI trong môi trường axit sunfuric loãng dư. Lượng I2 thoát ra trong phản ứng được chuẩn độ bằng lượng vừa đủ là 18 ml dung dịch Na2S2O3 0,05M.
Biết các phản ứng hóa học xảy ra:
(1) 6KI + K2Cr2O7 + 7H2SO4 → 4K2SO4 + Cr2(SO4)3 + 3I2 + 7H2O;
(2) I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
Nồng độ mol/l của K2Cr2O7 là
Bước 1: Tính số mol của Na2S2O3
nNa2S2O3 = 0,018.0,05 = 9.10-4 mol
Bước 2: Viết phương trình phản ứng, tính số mol các chất theo PTHH
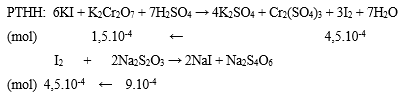
Bước 3: Tính CM của K2Cr2O7
⟹ CM K2Cr2O7 = 1,5.10-4/0,01 = 0,0015M.
Để xác định nồng độ dung dịch H2O2, người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M. Xác định hàm lượng H2O2 trong nước oxi già.
Biết phản ứng chuẩn độ: 5H2O2 + 2KMnO4 + 3H2SO4 ⟶ K2SO4 + 2MnSO4 + 5O2 + 8H2O.
Bước 1: Tính số mol của H2O2
\({n_{KMn{O_4}}} = 0,01.0,1 = 0,001\left( {mol} \right)\)
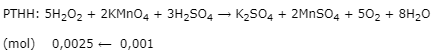
Bước 2: Xác định hàm lượng H2O2
\({m_{{H_2}{O_2}}} = 0,0025.34 = 0,085\left( g \right)\)
⟹ Hàm lượng H2O2 trong nước oxi già là \(\dfrac{{0,085}}{{0,5}}.100\% = 17\% \)
Để chuẩn độ 10 ml dung dịch FeSO4 trong dung dịch có H2SO4 loãng làm môi trường, thì cần dùng hết 20 ml dung dịch KMnO4 0,025M, nồng độ mol dung dịch FeSO4 là
- nKMnO4 = 0,025.0,02 = 0,0005 mol.
- PTHH xảy ra:
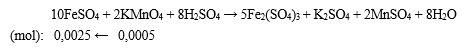
⟹ CM FeSO4 = n/V = 0,0025/0,01 = 0,25 M.
Hòa tan 50,0 gam hỗn hợp FeSO4 và Fe2(SO4)3 trong nước được 300,0 ml dung dịch. Thêm FeSO4 vào 20,0 ml dung dịch trên rồi chuẩn độ dung dịch này bằng dung dịch KMnO4, thấy dùng hết 30,0 ml dung dịch KMnO4 0,1M. Phần trăm khối lượng của FeSO4 trong hỗn hợp là
nKMnO4 = 3.10-3 (mol)
Bước 1: Viết PT ion thu gọn
- PT ion thu gọn:
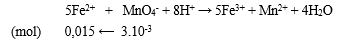
Bước 2: Tính số mol FeSO4 trong 300 ml dung dịch
- Như vậy trong 20 ml dung dịch có 0,015 mol FeSO4
⟹ Trong 300 ml dung dịch có 0,225 mol FeSO4
Bước 3: Tính % khối lượng FeSO4 trong hỗn hợp ban đầu.
- %mFeSO4 = \(\dfrac{{0,225.152}}{{50}}.100\% \) = 68,4%.

