Bài tập điện phân hỗn hợp muối
Kỳ thi ĐGNL ĐHQG Hà Nội
Điện phân dung dịch X chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1:3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A. Sau thời gian điện phân t (giờ) thu được dung dịch Y (chứa 2 chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
nCuSO4 = x(mol); nNaCl = 3x (mol)
Dung dịch X chứa 2 chất tan gồm: Na+: 3x (mol); SO4 2-: x mol => nOH - = x mol
Mặt khác nAl2O3 = 0,03 (mol) => nOH - = 2nAl2O3 = 0,06 (mol)
Xét tại cực Catot: nCu = 0,06 mol; nH2 = a mol
Anot: nCl2 = 0,09 mol; nO2 = b mol
=> 0,06 * 64 + 2a + 0,09 * 71 +32b = 12,45 (1)
Áp dụng định luật bảo toàn điện tích: 2a - 4b = 0,06 (2)
Từ (1) và (2) => a = 0,15; b = 0,06
=> ne trao đổi = 0,42 (mol)
=> ne trao đổi= It/F => t = 5,63 h
Điện phân dung dịch X gồm 0,2 mol NaCl và a mol Cu(NO3)2 (với các điện cực trơ, màng ngăn xốp, cường độ dòng điện không thay đổi), thu được dung dịch Y có khối lượng giảm 17,5 gam so với khối lưọng của X. Cho m gam Fe vào Y đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Z, khí NO (sản phẩm khử duy nhất của N+5) và (m - 0,5) gam hỗn hợp kim loại. Giả thiết hiệu suất điện phân là 100%, nước bay hơi không đáng kể. Giá trị của a là
Y + Fe sinh ra khí NO => Y chứa H+ => nước bị điện phân bên anot
Y +Fe sinh ra hỗn hợp kim loại => Cu2+ còn dư
* Anot: nCl2 = 0,1 mol; nO2 = x mol
* Catot nCu = y mol
Bảo toàn e ta có: 0,1 * 2 + 4x = 2y
m giảm = 0,1 * 71 + 32x +64y = 17,5
=> x = 0,025; y = 0,15
nH+ = 4nO2 = 0,1 (mol) => nNO = nH+/4 = 0,025 (mol)
nCu2+ dư =z
Bảo toàn electron: 2nFepứ=3nNO + 2nCu2+dư
=> nFepứ= z+ 0,0375 (mol)
=> m - 56*(z+0,0375)+64z = m -0,5 => z =0,2
Bảo toàn Cu => a = y +z = 0,35 (mol)
Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
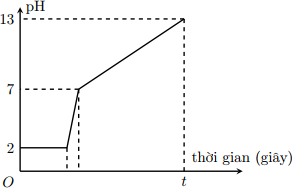
Giá trị của t trên đồ thị là
* Giai đoạn 1: pH = 2 => [H+] = 0,01 => nHCl = 0,008 (mol)
* Giai đoạn 3: pH = 13 => [OH-] = 0,1 => nNaOH = 0,08 (mol) => nNaCl = 0,08 (mol)
nCuCl2 = 0,08*0,02 = 0,016 (mol)
=> nCl- = 2 * nCuCl2 + nHCl + nNaOH = 0,12 (mol)
Vì ở giai đoạn 3, nước đã bị điện phân bên catot (sinh ra OH-) nên bên anot chỉ có Cl- điện phân.
=> nCl- = ne trao đổi = 0,12 (mol)
=> ne trao đổi = It/F => t = 1200s
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là:
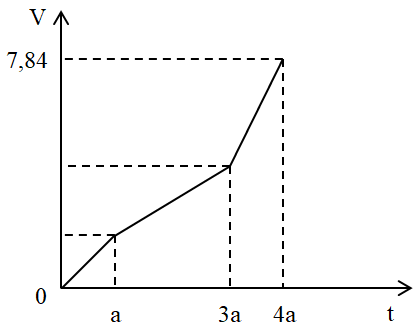
Đoạn 1: Chỉ có khí Cl2 thoát ra.
Đặt VCl2 = x (lít)
Đoạn 2: Chỉ có khí O2 thoát ra. (do khí thoát ra nó thoải hơn so với đoạn 3)
Mà ta thấy giá trị V lúc này gấp đôi đoạn tại thời điểm t = a (giây)
Do đó VO2 = 2x - x = x (lít)
Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra.
Trong đoạn 3 này thời gian bằng nửa đoạn 2 nên VO2 = 0,5x (lít)
Bảo toàn electron ta tính được VH2 = x (lít)
Tổng cộng 3 đoạn thì khí thoát ra gồm Cl2 (x lít), O2 (1,5x lít) và H2 (x lít)
Suy ra x + 1,5x + x = 7,84 → x = 2,24 lít
Ban đầu: nNaCl =2.nCl2 = 0,2 mol
Ta có: nCu(NO3)2 = nCu = nCl2 + 2.nO2 (đoạn 2) = 0,3 mol
Tại thời điểm t = a (giây): ne trao đổi = 2nCl2 = 2.2,24 : 22,4 = 0,2 mol
Tại thời điểm 3,5a (giây) (thuộc đoạn 3) ta có: ne trao đổi = 3,5. 0,2 = 0,7 mol
Catot:
Cu2+ + 2e → Cu
0,3 → 0,6 0,3 mol
H2O + 2e → H2 + 2OH-
0,1 → 0,05 mol
Anot:
2Cl- -2e → Cl2
0,2 0,2 0,1 mol
2H2O - 4e → O2 + 4H+
0,5 0,125 mol
Khi đó thu được 0,3 mol Cu ; 0,05 mol H2 ở catot và 0,1 mol Cl2 và 0,125 mol O2 ở anot.
Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực.
Do đó m = mCu + mH2 + mCl2 + mO2 = 0,3.64 + 0,05.2 + 0,1.71 + 0,125.32 = 30,4 (gam)
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch X chứa a mol MSO4 (M là kim loại) và 0,3 mol KCl trong thời gian t giây, thu được 2,24 lít khí ở anot (đktc) và dung dịch Y có khối lượng giảm m gam so với khối lượng dung dịch X. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z có khối lượng giảm 19,6 gam so với khối lượng dung dịch X. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Phát biểu nào sau đây là đúng?
Tại anot:
nCl2 max = 0,5.nKCl = 0,15 mol
- Thời điểm t giây, nCl2 max > nkhí = 0,1 mol → Cl- chưa bị điện phân hết
Cl- → 0,5 Cl2 + 1e
0,2 ← 0,1 → 0,2
→ ne(t) = 0,2 mol
- Thời điểm 1,4t giây:
ne(1,4t) = 1,4.ne(t) = 0,28 mol < nCl- = 0,3 mol
→ H2O chưa bị điện phân ở anot
Điện phân dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện I = 5A, sau thời gian 6176 giây thì dừng điện phân. Để yên bình điện phân đến khi phản ứng xảy ra hoàn toàn, thu được 0,06 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch X. Cho 400 ml dung dịch NaOH 1M vào X, lọc bỏ kết tủa, thu được dung dịch Y không màu. Cô cạn Y, lấy phần rắn đem nung đến khối lượng không đổi, thu được 29,64 gam chất rắn. Giá trị m là
\({n_e} = \frac{{It}}{F} = \frac{{5.6176}}{{96500}} = 0,32(mol)\)
Đặt mol của Cu(NO3)2 và NaCl trong hỗn hợp đầu lần lượt là x, y (mol)
- Do sinh ra khí NO nên có phản ứng của Cu với H+ và NO3- → Ở anot thì Cl- bị đp hết, H2O đang điện phân
TH1: Ở catot H2O chưa bị điện phân
Các quá trình điện phân tại các điện cực là:
Catot: Cu2+ + 2e → Cu
0,16 ← 0,32 → 0,16
Anot: Cl- → 0,5 Cl2 + 1e
H2O → 2H+ + 0,5 O2 + 2e
- Xét phản ứng tạo NO:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,09 ← 0,24 ← 0,06 ← 0,09 ← 0,06
(do nCu2+ > 0,16 mol → nNO3- > 0,32 mol → H+ hết)
Dung dịch Y chứa: Cu2+ (x - 0,16 + 0,09 = x - 0,07); Na+ (y) ; NO3- (2x - 0,06)
BTĐT → 2.(x - 0,07) + y = 2x - 0,06 → y = 0,08
- Cho 0,4 mol NaOH vào Y thu được dd không màu nên Cu2+ hết:
+) Nếu chất rắn chỉ chứa: Na+; NO3-
→ nNa+ = 0,08 + 0,4 = 0,48 mol
→ Chất rắn sau khi nung chứa 0,48 mol NaNO2
→ mNaNO2 = 0,48.69 = 33,12 gam ≠ 29,64 gam (loại)
+) Chất rắn chứa: Na+ (0,48); NO3- (2x-0,06) và OH-
BTĐT → nOH- = 0,54 - 2x (mol)
Chất rắn sau nung chứa: Na+ (0,48) và NO2- (2x-0,06) và OH- (0,54-2x)
→ 23.0,48+ 46(2x-0,06) + 17(0,54-2x) = 29,64
→ x = 0,21
Vậy m = 0,21.188 + 0,08.58,5 = 44,16 gam
TH2: Ở catot H2O đã bị điện phân (HS tự xét)
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Khí tại anot gồm nCl2 = 0,15 mol; nO2 = 0,05 mol
=> Bảo toàn nguyên tố Cl => nFeCl3 = 0,1 mol
=> Dung dịch sau phản ứng có chứa Cu2+ và Fe2+
=> Tại catot chỉ có chứa kim loại Cu
=>Sau điện phân dung dịch gồm: nCuSO4 = nFeSO4 = 0,1 (mol) và H2SO4 = x (mol)
Bảo toàn nguyên tố S => nCuSO4 (ban đầu) = nS = 0,2 +x
=> nCu ở catot = 0,1 + x (mol)
Áp dụng định luật bảo toàn => nFe3+ + 2 * nCu (catot) = 2 nCl2 + 4nO2
=> 0,1 + 2 * (0,1 +x) = 0,5 => x = 0,1 (mol)
m = nCuSO4 (ban đầu) + nFeCl3 = 0,3 * 160 + 0,1 * 162,5 = 64,25 (gam)
Điện phân dung dịch X chứa m gam CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi). Trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là:
Các quá trình có thể xảy ra ở 2 điện cực:
+) Catot: Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
+) Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
- Khi điện phân trong t giây:
nkhí Anot = 2,464: 22,4 = 0,11 mol
nCl2 = 0,5nCl- = 0,1 mol < 0,11 => Nước đã bị điện phân ở Anot
=> nO2 = nkhí anot – nCl2 = 0,11 – 0,1 = 0,01 mol
=> ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,01 = 0,24 mol
- Khi điện phân trong 2t giây:
=> Số mol electron trao đổi sẽ gấp đôi: ne trao đổi = 2.0,24 = 0,48 mol
+) Tại Anot: nCl2 = 0,1 mol
Có: ne = 2nCl2 + 4nO2 => nO2 = ¼ (0,48 – 2.0,1) = 0,07 mol
=> nkhí Anot = nCl2 + nO2 = 0,1 + 0,07 = 0,17 mol
nkhí = 5,824: 22,4 = 0,26 mol > 0,17 => Nước bị điện phân ở Catot
=> nH2(Catot) = 0,26 – 0,17 = 0,09 mol
- Bảo toàn e: ne trao đổi = 2nCu2+ + 2nH2 = 4nO2 + 2nCl2
=> nCu2+ = ½ (4.0,07 + 2.0,1 – 2.0,09) = 0,15 mol
=> m = mCuSO4 = 160.0,15 = 24g
Điện phân dung dịch X chứa KCl, K2SO4, CuSO4 với điện cực trơ, màng ngăn xốp trong t giây thu được dung dịch Y; ở anot thu được 4,312 lít hỗn hợp khí (đktc); khối lượng catot tăng lên 16,64 gam. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 114,65 gam hỗn hợp kết tủa. Điện phân dung dịch X trong thời gian 2t giây thu được 10,808 lít khí (đktc) ở cả hai điện cực. Khối lượng chất tan trong dung dịch X là
*t giây: Do dung dịch Y tác dụng với Ba(OH)2 dư thu được hỗn hợp kết tủa (BaSO4 và Cu(OH)2) nên suy ra Y chứa Cu2+ => Cu2+ chưa bị điện phân hết.
mCu = m catot tăng = 16,64 gam => nCu = 0,26 mol => ne(t) = 2nCu = 0,52 mol
Đặt nCl2 = x và nO2 = y (mol)
+ n khí anot = x + y = 4,312/22,4 (1)
+ BTe: ne(t) = 2nCl2 + 4nO2 => 2x + 4y = 0,52 (2)
Giải hệ (1) và (2) được x = 0,125 và y = 0,0675
BTNT "Cl" => nKCl = 2nCl2 = 0,25 mol
Giả sử X chứa: KCl (0,25 mol); K2SO4 (a mol) và CuSO4 (b mol)
Kết tủa gồm: Cu(OH)2 (b - 0,26) và BaSO4 (a + b)
=> m kết tủa = 98(b - 0,26) + 233(a + b) = 114,65 (*)
*2t giây: ne(2t) = 2ne(t) = 1,04 mol
nO2 = (ne(2t) - 2nCl2)/4 = (1,04 - 2.0,125)/4 = 0,1975 mol
=> nH2 = n khí 2 điện cực - nO2 - nCl2 = 0,4825 - 0,1975 - 0,125 = 0,16 mol
BTe: ne(2t) = 2nCu + 2nH2 => 2b + 2.0,16 = 1,04 => b = 0,36
Thay b = 0,36 vào (*) suy ra a = 0,09
Vậy: m chất tan trong X = 0,25.74,5 + 0,09.174 + 0,36.160 = 91,885 gam

