I. Vị trí, cấu hình nguyên tử và tính chất vật lý của iron
1. Vị trí, cấu hình electron nguyên tử
- Iron nằm ở ô số 26, nhóm VIIB, chu kì 4 trong bảng tuần hoàn.
- Cấu hình electron:
Fe (Z = 26): 1s22s22p63s23p63d64s2
- Nguyên tử iron dễ dàng nhường đi 2 hoặc 3 electron để trở thành ion Fe2 hoặc Fe3+.
2. Tính chất vật lý của iron
- Iron là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ cao.
- Iron có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
- Iron là kim loại nặng (D = 7,9 g/cm3)

II. Iron tác dụng với phi kim
- Tính chất hóa học cơ bản của iron là tính khử trung bình:
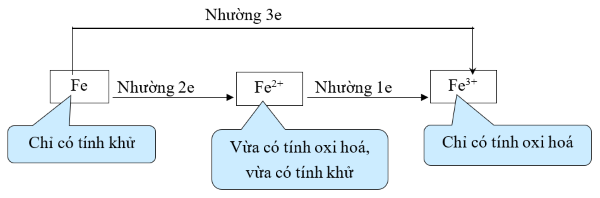
Chú ý dạng câu hỏi lí thuyết: Chất vừa có tính oxi hóa vừa có tính khử, phải xem xét ion Fe3+ (chỉ có tính oxi hóa) và các ion mang điện tích âm (có thể có tính khử). Ví dụ FeCl3 vừa có tính oxi hóa vừa có tính khử.
Iron tác dụng với phi kim
- Với phi kim là chất oxi hóa mạnh như clo, … Fe bị oxi hóa thành Fe3+
2Fe + 3Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3
- Với oxygen tạo ra oxide iron từ (có thể tạo ra hỗn hợp FeO và Fe2O3)
3Fe + 2O2 \(\xrightarrow{{{t^o}}}\) Fe3O4
- Với phi kim là chất oxi hóa trung bình như S thì Fe bị oxi hóa thành Fe2+
Fe + S \(\xrightarrow{{{t^o}}}\) FeS
III. Iron tác dụng với dung dịch acid
- Fe tác dụng với acid HCl và H2SO4 loãng sinh ra muối Fe2+ và khí H2
Fe + 2HCl → FeCl2 + H2
- Fe tác dụng với acid HNO3 và H2SO4 đặc nóng sinh ra muối Fe3+ và sản phẩm khử
Fe \(\xrightarrow{{ + \,HN{O_3},\,{H_2}S{O_4}\,đặc,\,{t^o}}}\) Fe3+ + sản phẩm khử của \(\mathop N\limits^{ + 5} ,\,\,\mathop S\limits^{ + 6} \,\) + H2O (*)
- Đối với phản ứng (*) nếu Fe dư thì:
Fe + 2Fe3+ → 3Fe2+
Fe thụ động trong HNO3 đặc nguội hoặc H2SO4 đặc nguội
IV. Iron tác dụng với dung dịch muối và hơi nước
1. Tác dụng với dung dịch muối
Iron đẩy được các kim loại đứng sau nó trong dãy điện hóa của kim loại ra khỏi dung dịch muối. Trong các phản ứng này, Fe thường bị oxi hóa hoá thành Fe2+.
Fe + CuSO4 → FeSO4 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
- Nếu Fe dư thì sau phản ứng thu được: chất rắn gồm Ag và Fe dư, dung dịch chỉ có Fe(NO3)2
- Nếu AgNO3 dư thì xảy ra phản ứng:
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag (2)
Sau phản ứng thu được: chất rắn chỉ có Ag (1+2); dung dịch chứa Fe(NO3)3 và AgNO3 dư.
2. Tác dụng với hơi nước
Iron chỉ khử được hơi nước ở nhiệt độ cao, tạo H2 và Fe3O4 hoặc FeO.
\(3Fe\,\, + \,\,4{H_2}O\,\,\xrightarrow{{ < {{570}^o}C}}\,\,F{e_3}{O_4}\, + \,4{H_2}\)
\(Fe\,\, + \,\,{H_2}O\,\,\xrightarrow{{ > {{570}^o}C}}\,\,FeO\, + \,{H_2}\)
V. Trạng thái tự nhiên của iron
- Iron tồn tại chủ yếu ở dạng hợp chất trong tự nhiên (quặng iron):
+ Quặng hematite đỏ chứa Fe2O3 khan, quặng hematite nâu chứa Fe2O3.nH2O
+ Quặng magnetite chứa Fe3O4 là quặng giàu iron nhất.
+ Quặng siderite chứa FeCO3, quặng pyrite chứa FeS2.
- Iron còn có trong hemoglobn của máu, vận chuyển oxygen để duy trì sự sống.
- Iron tự do có trong các thiên thạch từ Vũ trụ rơi vào Trái Đất.
VI. Iron (II) oxide
Hợp chất iron (II) vừa có tính oxi hóa, vừa có tính khử:
\(Fe\,\,\xleftarrow{{nhận\,e}}\,F{e^{2 + }}\,\xrightarrow{{cho\,e}}\,F{e^{3 + }}\)
Iron (II) oxide – FeO
- FeO là chất rắn màu đen, không tan trong nước, không có trong tự nhiên.

- FeO có các tính chất hóa học của oxide base:
FeO + 2HCl → FeCl2 + H2O
- FeO là chất oxi hóa khi tác dụng với chất khử mạnh như H2, CO, Al,...:
Ví dụ: FeO + H2 → Fe + H2O
- FeO là chất khử khi tác dụng với các chất oxi hóa mạnh như HNO3, H2SO4 đặc, nóng:
FeO \(\xrightarrow{{ + \,HN{O_3},\,{H_2}S{O_4}\,đặc,\,{t^o}}}\) dung dịch muối Fe3+
Ví dụ: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
VII. Iron (II) hydroxide và muối iron (II)
1. Iron (II) hydroxide – Fe(OH)2
- Fe(OH)2 là chất rắn màu trắng hơi xanh, là base không tan trong nước.
_hydroxide_mau_trang_hoi_xanh.png)
- Fe(OH)2 bị oxi hóa trong không khí:
Fe(OH)2 + O2 + H2O → Fe(OH)3
(trắng xanh) (nâu đỏ)
- Fe(OH)2 dễ bị nhiệt phân:
+ Trong chân không:
Fe(OH)2 \(\xrightarrow{{{t^o}}}\) FeO + H2O
+ Trong không khí:
4Fe(OH)2 + O2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 4H2O
3. Muối iron (II)
- Dễ bị oxi hóa thành muối iron (III):
Muối Fe2+ \(\xrightarrow{{oxi\,\,hóa}}\) muối Fe3+
Ví dụ:
2FeCl2 + Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3
lục nhạt vàng nâu
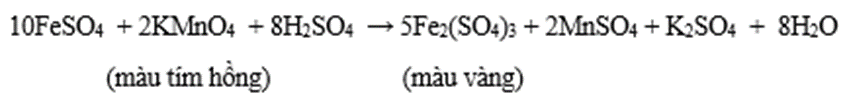
VIII. Iron (III) oxide
- Ion Fe3+ nhận 1 hoặc 3e để trở thành Fe2+ hoặc Fe => tính chất đặc trưng của hợp chất iron (III) là tính oxi hóa.
- Các hợp chất iron (III) tác dụng với HNO3 hoặc H2SO4 đặc, nóng không sinh ra khí.
Iron (III) oxide – Fe2O3
- Fe2O3 là chất rắn màu đỏ nâu, không tan trong nước.

- Fe2O3 là oxide base, dễ tan trong acid mạnh:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
- Fe2O3 là chất oxi hóa:
Fe2O3 \(\xrightarrow{{ + \,Al,\,{H_2},\,CO,\,C}}\) Fe
PTHH: Fe2O3 + Al \(\xrightarrow{{{t^o}}}\) Al2O3 + 2Fe
Lưu ý: Fe3O4 là hỗn hợp FeO và Fe2O3
IX. Iron (III) hydroxide và muối iron (III)
1. Iron (III) hydroxide – Fe(OH)3
- Fe(OH)3 là chất rắn màu nâu đỏ, không tan trong nước.
3_mau_nau_do.jpg)
- Fe(OH)3 là base, dễ tan trong acid mạnh:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
- Fe(OH)3 bị nhiệt phân tạo thành oxide:
2Fe(OH)3 \(\xrightarrow{{{t^o}}}\) Fe2O3 + 3H2O
2. Muối iron (III)
- Muối iron (III) có tính oxi hóa, dễ bị khử thành muối iron (II).
PTHH: Fe2(SO4)3 + Cu → 2FeSO4 + CuSO4
2FeCl3 + H2S → 2FeCl2 + 2HCl + S
(vàng nâu) (vàng lục)
- Các muối iron (III) bị thủy phân trong môi trường kiềm
PTHH: 2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3 + 6NaCl + 3CO2

