I. Vị trí và cấu tạo của oxygen
- O (Z = 8): 1s22s22p4 → Oxgen ở ô thứ 8, thuộc chu kì 2, nhóm VIA trong bảng tuần hoàn hóa học.
- Cấu tạo phân tử O2: 2 nguyên tử O liên kết với nhau bằng liên kết cộng hóa trị không phân cực.
Công thức cấu tạo O2: O = O
II. Tính chất vật lý của oxygen
- Khí không màu, không mùi.
- Nặng hơn không khí, ít tan trong nước.
- Oxygen lỏng có màu xanh nhạt (hóa lỏng ở -183oC) .

Oxygen lỏng
III. Oxygen tác dụng với kim loại
- Oxygen là một phi kim hoạt động, có tính oxi hóa mạnh (do có độ âm điện lớn, chỉ kém F).
- Trong hợp chất (ngoại trừ với fluor), nguyên tố oxygen có số oxi hóa là -2.
Oxygen tác dụng với kim loại
Oxygen tác dụng với hầu hết các kim loại (trừ Ag, Au, Pt) tạo thành oxide. Các phản ứng thường xảy ra ở nhiệt độ cao.
- Oxygen tác dụng với sắt ở nhiệt độ cao tạo các hạt nhỏ màu nâu là sắt (II, III) oxide, công thức hóa học là Fe3O4, thường được gọi là oxide sắt từ:
30Fe+20O2to→+8/3Fe3−2O4(nâuđỏ)
Video thí nghiệm sắt tác dụng với oxygen
IV. Oxygen tác dụng với phi kim
Oxygen phản ứng với hầu hết các phi kim (trừ halogene)
- Oxygen tác dụng với carbon:
0C+0O2to→+4C−2O2
- Oxygen tác dụng với phosphor tạo chất rắn màu trắng là diphosphor pentoxide:
40P+50O2to→2+5P2−2O5
V. Oxygen tác dụng với hợp chất có tính khử
- Khí methane (trong bùn ao, khí biogas) cháy trong không khí do tác dụng với oxygen, tỏa nhiều nhiệt:
−4CH4+20O2to→+4CO2+2H2−2O
- Oxygen tác dụng với FeS2:
4+2Fe−1S2+110O2to→2+3Fe2−2O3+8+4S−2O2
VI. Ứng dụng của oxygen
- Có vai trò quyết định đối với sự sống của người và động vật. Oxygen không thể thiếu đối với quá trình hô hấp.
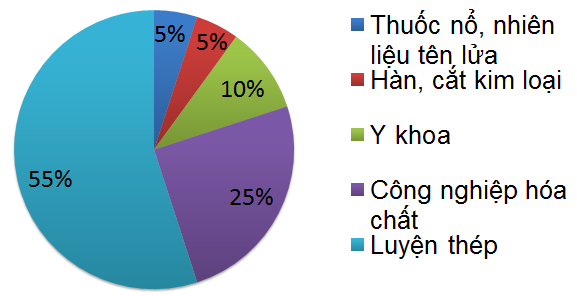
- Oxygen cũng được dùng nhiều trong công nghiệp hóa chất, luyện thép, y khoa, hàn cắt kim loại...
VII. Điều chế oxygen
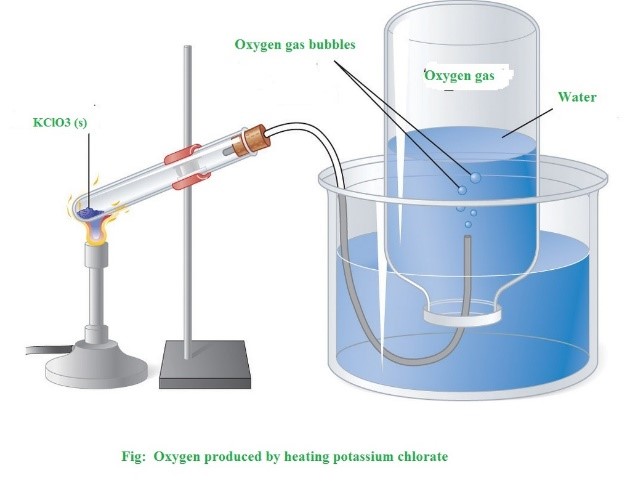
1. Trong phòng thí nghiệm
Oxygen được điều chế bằng cách nhiệt phân những hợp chất giàu oxygen và ít bền với nhiệt như KMnO4 (rắn) và KClO3 (rắn)...
Ví dụ:
2KMnO4to→ K2MnO4 + MnO2 + O2
2KClO3to→ 2KCl + 3O2
2. Trong công nghiệp
- Từ không khí lỏng: Oxgen được điều chế bằng cách chưng cất phân đoạn không khí lỏng.
- Từ nước: Điện phân nước có hòa tan một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước. Khí oxygen sau đó thoát ra ở cực dương và khí hidro thoát ra ở cực âm.
2H2Ođiệnphân→2H2↑+O2↑

