I. Định nghĩa, phân loại carboxylic acid
1. Định nghĩa
- Carboxylic acid là hợp chất hữu cơ mà phân tử có nhóm –COOH liên kết với gốc hydrocarbon, với H hoặc với nhau.
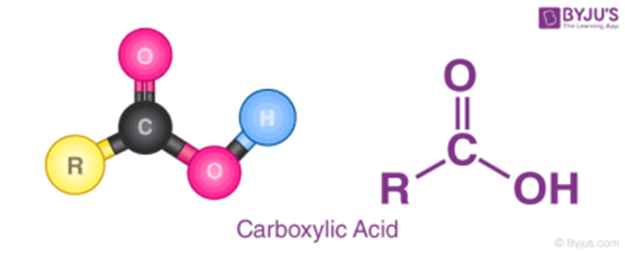
- Công thức tổng quát của acid:
+ CxHyOz (x, y, z là các số nguyên dương; y chẵn; z chẵn; 2 ≤ y ≤ 2x + 2 – 2z): thường dùng khi viết phản ứng cháy.
+ CxHy(COOH)z hay R(COOH)z: thường dùng khi viết phản ứng xảy ra ở nhóm COOH.
+ CnH2n+2-2k-z(COOH)z (k = số liên kết pi + số vòng): thường dùng khi viết phản ứng cộng H2, cộng Br2,…
2. Phân loại
- Dựa vào cấu tạo gốc hydrocarbon: acid no, không no, thơm.
- Dựa vào số nhóm –COOH: acid đơn chức, đa chức.
a. Acid no, đơn chức, mạch hở
CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1)
b. Acid không no chứa 1 liên kết đôi C=C, đơn chức, mạch hở
CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3)
c. Acid no, 2 chức, mạch hở
CnH2n(COOH)2 (n ≥ 0) hoặc CmH2m-2O4 (m ≥ 1)
II. Danh pháp của carboxylic acid
1. Tên thay thế
Tên hydrocarbon tương ứng theo mạch chính (mạch chính bắt đầu từ nguyên tử C của nhóm –COOH) + oic + acid
2. Tên thường của một số acid thường gặp
Có nguồn gốc tìm ra chúng, tùy thuộc vào từng acid.
Ví dụ:
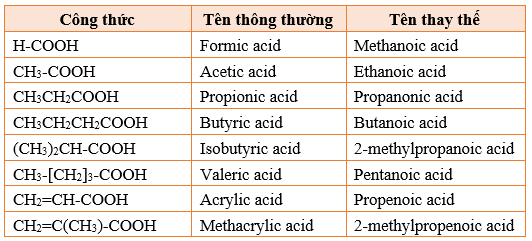
Tên gọi một số acid no, đơn chức, mạch hở
III. Tính chất vật lý của carboxylic acid
1. Nhiệt độ sôi
- Ở điều kiện thường, các carboxylic acid đều là những chất lỏng hoặc rắn.
- Acid có nhiệt độ sôi cao hơn alcohol có khối lượng phân tử tương đương vì phân tử acid tạo được 2 liên kết hydrogen và liên kết hydrogen giữa các phân tử acid bền hơn liên kết hydrogen giữa các phân tử alcohol.
2. Tính tan
- Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
IV. Phương pháp giải bài tập tính axit của axit cacboxylic
I. SO SÁNH TÍNH AXIT GIỮA CÁC PHÂN TỬ AXIT
- Phân tử axit có nhóm cacbonyl C=O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O–H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH ⇆ RCOO- + H+
(RCOOH + H2O \overset{{}}{\leftrightarrows} RCOO- + H3O+)
- Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
- Nếu nhóm COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH. Gốc ankyl càng có nhiều nguyên tử H thì tính axit càng giảm.
- Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH. Càng nhiều gốc hút e thì tính axit càng mạnh. Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
II. CÁC PHẢN ỨNG THỂ HIỆN TÍNH AXIT
- Axit làm quỳ tím chuyển thành màu hồng.
- Tác dụng với bazơ → muối + H2O
R(COOH)x + xNaOH → R(COONa)x + xH2O
- Tác dụng với oxit bazơ → muối + H2O
2R(COOH)x + xNa2O → 2R(COONa)x + xH2O
- Tác dụng với kim loại đứng trước H → muối + H2
2R(COOH)x + xMg → [2R(COO)x]Mgx + xH2
→ Phản ứng này có thể dùng để nhận biết axit.
- Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
R(COOH)x + xNaHCO3 → R(COONa)x + xH2O + xCO2
→ Thường dùng muối cacbonat hoặc hiđrocacbonat để nhận biết các axit.
Phương pháp giải bài tập phản ứng của axit cacboxylic với kiềm
- Tỉ lệ số mol NaOH (hoặc KOH): axit có thể được dùng để xác định số nhóm chức trong phân tử axit
+ Nếu tỉ lệ = 1 thì axit tham gia phản ứng là axit đơn chức.
+ Nếu tỉ lệ = n thì axit tham gia phản ứng là axit n chức.
- Cô cạn dung dịch sau phản ứng thì chất rắn thu được gồm muối và kiềm dư (nếu có):
mchất rắn sau phản ứng = mmuối + mkiềm dư
- Phương pháp tăng giảm khối lượng:
mmuối - maxit phản ứng = 22.nNaOH phản ứng
mmuối - maxit phản ứng = 38.nKOH phản ứng
Phương pháp giải bài tập phản ứng của axit cacboxylic với kim loại
- Axit cacboxylic phản ứng được với kim loại đứng trước H trong dãy hoạt động hóa học của kim loại tạo thành muối và giải phóng khí H2 (thường gặp là phản ứng với kim loại kiềm).
- Khi giải bài tập về phản ứng của axit cacboxylic tác dụng với kim loại cần lưu ý:
+ Bảo toàn nguyên tố H: {{n}_{{{H}_{2}}}}~=\text{ }\frac{1}{2}.{{n}_{COOH}}
+ Bảo toàn khối lượng: mmuối = mkim loại + maxit - {{m}_{{{H}_{2}}}}
+ Tăng giảm khối lượng: mmuối - maxit = mkim loại - {{m}_{{{H}_{2}}}}
Chú ý:
- HCOOH có phản ứng tương tự như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
- Các axit không no còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dd → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
V. Phương pháp giải bài tập phản ứng este hóa
I. PHẢN ỨNG ESTE HÓA
a) Phản ứng của axit axetic với etanol xúc tác axit H2SO4 đặc là phản ứng thuận nghịch
- Phương pháp thường dùng để điều chế este của ancol là tiến hành phản ứng este hóa, đun hồi lưu ancol và axit hữu cơ, có H2SO4 đặc làm xúc tác.
CH3COOH + C2H5OH \overset{{{H}_{2}}S{{O}_{4}}\,,{{t}^{o}}}{\leftrightarrows} CH3COOC2H5 + H2O
b) Este sinh ra bởi axit, ancol bất kì:
R(COOH)n + R’(OH)m \overset{{{H}_{2}}S{{O}_{4}}\,\,,{{t}^{o}}}{\leftrightarrows} Rm(COO)n.mR’n + n.m H2O
Ví dụ: 3CH2(COOH)2 + 2C3H5(OH)3 \overset{{{H}_{2}}S{{O}_{4}}\,\,,{{t}^{o}}}{\leftrightarrows} (CH2)3(COO)6(C3H5)2 + 6H2O
- Phản ứng este hóa là phản ứng thuận nghịch. Chiều thuận là phản ứng este hóa, chiều nghịch là phản ứng thủy phân este.
- Để tăng hiệu suất phản ứng thuận:
+ Tăng nồng độ chất tham gia.
+ Giảm nồng độ sản phẩm bằng cách: đun nóng để este bay hơi hoặc dùng H2SO4 đặc để hút nước. H2SO4 đặc vừa là xúc tác, vừa làm tăng hiệu suất phản ứng.
* Riêng đối với este của phenol:
- Các este chứa gốc phenyl không điều chế được bằng phản ứng của axit cacboxylic với phenol mà phải dùng anhiđrit axit hoặc clorua axit tác dụng với phenol.
(CH3CO)2O + C6H5OH → CH3COOC6H5 + CH3COOH
2. TÍNH HẰNG SỐ CÂN BẰNG:
RCOOH + R’OH \overset{{{H}_{2}}S{{O}_{4}}\,\,,{{t}^{o}}}{\leftrightarrows} RCOOR’ + H2O
Bđ a mol b mol
Pư x mol x mol x mol x mol
Sau pư (a-x) mol (b-x) mol
KC = \frac{[RCOO{{R}^{'}}][{{H}_{2}}O]}{[RCOOH][{{R}^{'}}OH]}=\frac{\frac{x}{V}\times \frac{x}{V}}{\frac{a-x}{V}\times \frac{b-x}{V}}=\frac{{{x}^{2}}}{\left( a-x \right)\left( b-x \right)}
3. TÍNH HIỆU SUẤT CỦA PHẢN ỨNG ESTE HÓA:
* Nếu a \ge b => H = x∕b . 100 => x = \frac{H\times b}{100} ; b = \frac{x\times 100}{H}
* Nếu a < b => H = x∕a . 100 => x = \frac{H\times a}{100} a = \frac{x\times 100}{H}
Phương pháp giải nhanh
+ Áp dụng định luật bảo toàn khối lượng: mancol + maxit = meste + mnước
+ Hiệu suất phản ứng este hoá H = \frac{{{m}_{este\,\,TT}}}{{{m}_{este\,\,LT}}}.100%
VI. Phương pháp giải bài tập đốt cháy axit cacboxylic
- Phương trình phản ứng tổng quát:
CxHyOz + (x+\frac{y}{4}\text{-}\frac{z}{2}) O2 \xrightarrow{{{t}^{o}}} xCO2 + \frac{y}{2} H2O
- Dựa vào đặc điểm của phản ứng đốt cháy có thể kết luận được loại axit tham gia phản ứng.
Thường gặp nhất là các trường hợp sau:
+ Nếu đốt cháy axit thu được nCO2 = nH2O thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH → (n + 1)CO2 + (n + 1)H2O
hoặc CmH2mO2 → nCO2 + nH2O
+ Nếu đốt cháy axit thu được {{n}_{C{{O}_{2}}}}~-\text{ }{{n}_{{{H}_{2}}O}}~={{n}_{axit}}~thì axit thuộc loại no, 2 chức, mạch hở hoặc không no, 1 liên kết đôi C = C, mạch hở, đơn chức:
CnH2n-2O4 → nCO2 + (n - 1)H2O.
CnH2n-2O2 → nCO2 + (n - 1)H2O.
- Khi giải bài toán về phản ứng đốt cháy axit cacboxylic cần phải căn cứ vào các đặc điểm kể trên, kết hợp với các định luật bảo toàn nguyên tố, bảo toàn khối lượng, các công thức tính số nguyên tử C, H... như trong bài toán đốt cháy các chất hữu cơ khác.
VII. Điều chế carboxylic acid
1. Phương pháp điều chế chung
- Oxi hóa không hoàn toàn hydrocarbon, alcohol, aldehyde:
C6H5-CH3 \xrightarrow[{{H_2}O,{t^o}}]{{KMn{O_4}}} C6H5COOK \xrightarrow{{{H_3}{O^ + }}} C6H5-COOH
+ Oxi hóa aldehyde:
R(CHO)x + \frac{x}{2} O2 → R(COOH)x
- Đi từ dẫn xuất halogen:
R-X \xrightarrow{{KCN}} R-C≡N \xrightarrow{{{H_3}{O^ + },{t^o}}} R-COOH
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O
- Thủy phân este trong môi trường acid
CH3COOC2H5 + H2O \overset {} \leftrightarrows CH3COOH + C2H5OH
Tổng quát:
Ry(COO)xyR’y + xyH2O \overset {} \leftrightarrows yR(COOH)x + xR’(OH)y
2. Điều chế CH3COOH
- Lên men giấm là phương pháp cổ nhất, ngày nay chỉ còn dùng để sản xuất giấm ăn
CH3CH2OH + O2 \xrightarrow[{25 - {{30}^o}C}]{{men\,\,giấm}} CH3COOH + H2O
- Đi từ buthane:
n-C4H10 + \frac{5}{2}O2 \xrightarrow{{M{n^{2 + }},{t^o}}} 2CH3COOH + H2O
- Oxi hóa acetic aldehyde trước đây là phương pháp chủ yếu sản xuất acetic acid:
CH3CH=O + \frac{1}{2}O2 \xrightarrow{{xt,{t^o}}} CH3COOH
- Đi từ methanol và carbon oxide, nhờ xúc tác thích hợp là phương pháp hiện đại sản xuất acetic acid:
CH3OH + CO \xrightarrow{{xt,{t^o}}} CH3COOH
VIII. Ứng dụng của carboxylic acid
1. Acetic acid
Acetic acid được dùng để điều chế những chất có ứng dụng quan trọng: tổng hợp chất diệt cỏ, dùng làm chất cầm màu khi nhuộm vải, sợi, cellulose acetate...
2. Các acid khác
- Các acid béo như panmitic acid (C15H31COOH), stearic acid (C17H35COOH),... được dùng để chế xà phòng.
- Benzoic acid được dùng trong tổng hợp phẩm nhuộm, nông dược,... Salixylic acid dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau,...
- Các dicarboxylic acid (như adipic acid, phthalic acid,...) được dùng trong sản xuất polyamide, polyester để chế tơ sợi tổng hợp.

