I. Vị trí và cấu hình electron của phosphor
- Phosphor (Z =15): 1s22s22p63s23p3.
- Trong bảng tuần hoàn hóa học phosphor: ở ô thứ 15, nhóm VA, chu kì 3.
- Trong hợp chất hóa trị của P có thể là 5 (so có 5 electron ở lớp ngoài cùng), trong một số hợp chất P có hóa trị 3.
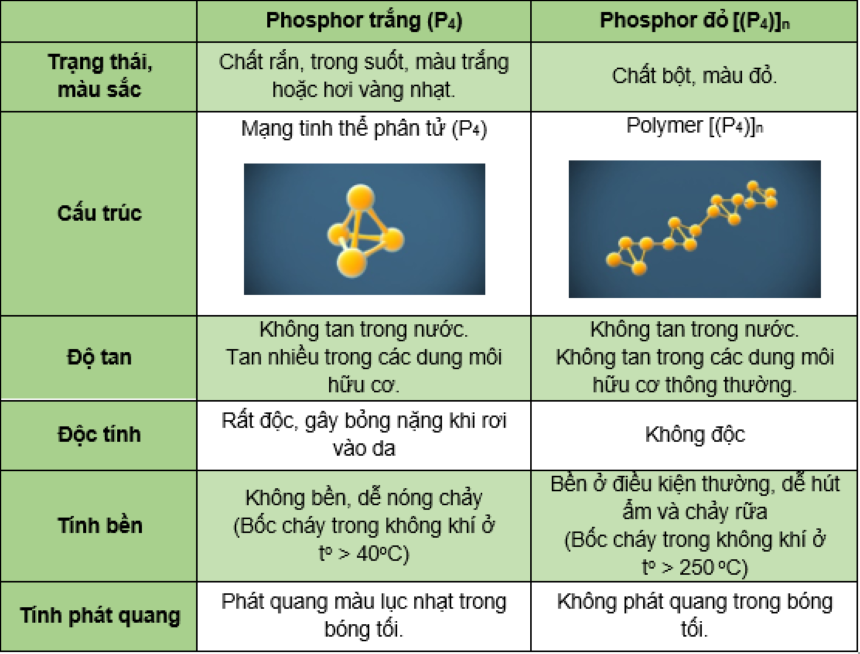
II. Tính chất vật lý của phosphor
III. Tính oxi hóa của phosphor
- Các mức oxi hóa có thể có của P: -3, 0, +3, +5
- P hoạt động hóa học mạnh hơn N2 vì liên kết P - P kém bền hơn so với liên kết N≡ N
- P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử còn P đỏ có cấu trúc kiểu polymer).
Tính oxi hóa của phosphor
- Tính oxi hóa thể hiện khi P có phản ứng với một số kim loại hoạt động tạo thành phosphide kim loại:
20P+3Mgto→Mg3P2 (magnesium phosphide)
- Các muối phosphide bị thủy phân mạnh giải phóng phosphin (PH3).
Ca3P2 + 6H2O → 2PH3↑ + 3Ca(OH)2
Phosphin là một khí không màu rất độc, có mùi tỏi, bốc cháy trong không khí ở nhiệt độ gần 150oC.
2PH3+ 4O2to→P2O5+ 3H2O

IV. Phosphor tác dụng với oxygen
Phosphor cháy trong không khí khi đốt nóng:
4P + 3O2 thiếu to→ 2P2O3 (diphospho trioxitde)
4P + 5O2 dư to→ 2P2O5 (diphospho pentoxide)
Lưu ý:
- P trắng phản ứng được ở ngay nhiệt độ thường và có hiện tượng phát quang hóa học.
- P đỏ chỉ phản ứng khi nhiệt độ > 2500C.
V. Phosphor tác dụng với halogen
Phosphor tác dụng với halogen khi đốt nóng:
2P + 3Cl2 thiếu to→ 2PCl3
2P + 5Cl2 dư to→ 2PCl5
Hợp chất phosphorus halide dễ bị thủy phân:
PX3 + 3H2O → H3PO3 + 3HX (X: Cl, Br, I)
PX5 + 4H2O → H3PO4 + 5HX
VI. Phosphor tác dụng với các chất oxi hóa khác
Phosphor thể hiện tính khử khi tác dụng với các hợp chất có tính oxi hóa:
60Pđỏ+5K+5ClO3to→3+5P2O5+5K−1Cl (phản ứng xảy ra khi quẹt diêm)
60Ptrắng+5K2+6Cr2O7to→5K2O+5+3Cr2O3+3+5P2O5
0P+5H+5NO3đặcto→H3+5PO4+5+4NO2+H2O
VII. Trạng thái tự nhiên của phosphor
- Trong tự nhiên phosphor nằm ở dạng muối của phosphoric acid. Hai khoáng vật chính của phosphor là aptite 3Ca3(PO4)2.CaF2 và phosphorite Ca3(PO4)2.
- Ngoài ra, phospho còn có trong protein của thực vật; trong xương, răng, tế bào não của con người và động vật.

VIII. Ứng dụng và sản xuất phosphor
1. Ứng dụng
- Phần lớn dùng để sản xuất phosphoric acid, phần còn lại chủ yếu sản xuất diêm.
- Phosphor được dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói…

2. Sản xuất
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO (lò điện ở 15000C)

