I. ĐỊNH NGHĨA
Phenol là loại hợp chất mà phân tử có nhóm –OH liên kết trực tiếp với vòng benzen.
Cách gọi tên: Tên phenol = Số chỉ vị trí nhóm thế + tên nhóm thế + phenol
Ví dụ:
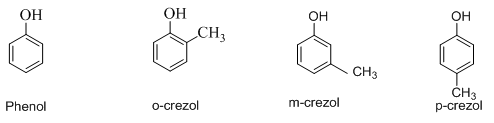
Chú ý:
Phân biệt rượu thơm có nhóm –OH dính vào mạch nhánh của vòng benzen.
Ancol thơm: C6H5-CH2-OH và phenol HO-C6H4-CH3
II. PHENOL
1. Tính chất vật lý
- Trạng thái: Chất rắn, không màu ( để lâu chuyển thành màu hồng do bị oxi hóa)
- Độ tan: tan ít trong nước lạnh, nhưng tan nhiều trong nước nóng.
- Phenol rất độc, khi dây vào tay có thể gây bỏng.
2. Tính chất hóa học
a. Phản ứng thế nguyên tử H của nhóm –OH
- Phản ứng với kim loại kiềm
2C6H5OH+2Na→2C6H5ONa+H2Natriphenolat
- Phản ứng với dung dịch kiềm
C6H5OH+NaOH→C6H5ONa+H2ONatriphenolat
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
=> phenol có tính axit. Tính axit của phenol rất yếu, yếu hơn nấc 1 và mạnh hơn nấc 2 của axit H2CO3 và không làm đổi màu quỳ tím.
b. Phản ứng thế H của vòng benzen
+ Tác dụng với dung dịch brom
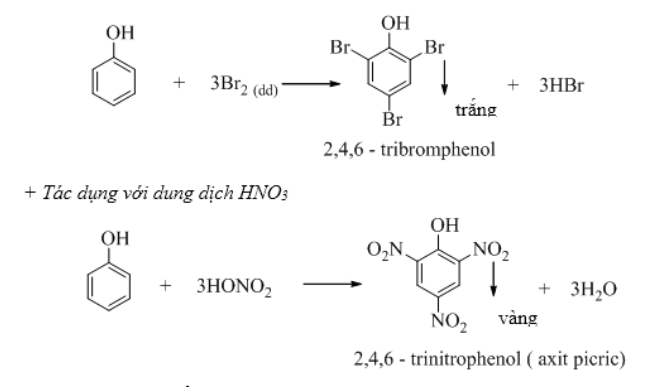
3. Ảnh hưởng qua lại giữa các nhóm nguyên tử trong phân tử phenol
- Ảnh hưởng của nhóm –OH đến vòng benzen: Nguyên tử H của vòng benzen trong phân tử phenol dễ bị thay thế hơn nguyên tử H của vòng benzen trong phần tử hiđrocacbon thơm.
- Ảnh hưởng của vòng benzen lên nhóm –OH: phenol có tính axit yếu (tác dụng với NaOH) còn ancol thì không.
Giải thích:
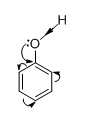
|
- Cặp electron chưa tham gia liên kết của nguyên tử Oxi tham gia liên hợp với các electron π của vòng benzen => làm cho mật độ electron di chuyển vào vòng benzen, làm cho mật độ electron ở vòng benzen tăng lên, nhất là ở các vị trí o và p " phản ứng thế ở vòng benzen dễ hơn. |
|
=> liên kết O – H trở nên phân cực hơn (so với OH của ancol) " Dung dịch phenol có tính axit yếu (dung dịch phenol không làm đổi màu quì tím).
=> liên kết C – O trở nên bền vững hơn so với ancol " nhóm OH của phenol không bị thế bởi gốc axit như ở ancol.
III. ỨNG DỤNG
- Dùng để điều chế chất dẻo, chất kết dính, dược phẩm, phẩm nhuộm, chất diệt cỏ, thuốc trừ sâu, chất diệt nấm mốc, thuốc nổ (2,4,6- trinitrophenol).