I. Cấu tạo của kim loại
1. Cấu tạo nguyên tử
- Nguyên tử của các nguyên tố kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
Ví dụ:
3Li: 1s22s1; 20Ca: 1s22s22p63s23p64s2; 13Al: 1s22s22p63s23p1
- Trong một chu kì, bán kính nguyên tử của nguyên tố kim loại lớn và điện tích hạt nhận thì hỏ hơn hơn so với nguyên tử nguyên tố phi kim.
2. Cấu tạo tinh thể
- Thủy ngân là kim loại duy nhất tồn tại ở thể lỏng ở điều kiện thường, còn các kim loại khác ở thể rắn và có cấu tạo tinh thể.
- Có 3 kiểu mạng tinh thể kim loại phổ biến:
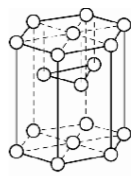
a. Mạng tinh thể lục phương
Các nguyên tử, ion kim loại nằm trên các đinh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là các khe rỗng. Mạng tinh thể lục phương này có các kim loại: Be, Mg, Zn,...
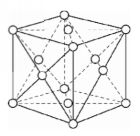
b. Mạng tinh thể lập phương tâm diện
Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là các khe rỗng. Thuộc loại này có các kim loại : Cu, Ag, Au, Al,...
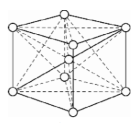
c. Mạng tinh thể lập phương tâm khối
Các nguyên tử, ion dương kim loại nằm trên các đỉnh và tâm của hình lập phương.
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chỉ chiếm 68%, còn lại 32% là các khe rỗng. Thuộc loại này có các kim loại : Li, Na, K, V, Mo,...
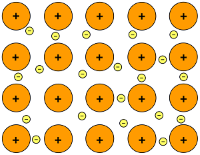
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
II. Vị trí của kim loại trong bảng tuần hoàn
Trong bảng tuần hoàn, các nguyên tố kim loại có mặt ở:

III. Tính chất vật lý của kim loại
1. Tính chất chung

2. Tính chất riêng

IV. Kim loại tác dụng với phi kim
Tính chất hóa học đặc trưng của kim loại là tính khử:
M → Mn+ + ne
Kim loại tác dụng với phi kim
a. Tác dụng với chlorine
Hầu hết các kim loại đều có thể khử trực tiếp chlorine tạo thành muối chloride:
2M+nCl2to→2MCln
Ví dụ:
2Cu + O2 to→ 2CuO
2Fe + 3Cl2 to→ 2FeCl3
b. Tác dụng với oxi
Hầu các kim loại có thể khử oxi từ số oxi hóa 0 xuống số oxi hóa -2.
4Al + 3O2 to→ 2Al2O3
c. Tác dụng với lưu huỳnh
Nhiều kim loại có thể phản ứng với lưu huỳnh khi đun nóng. Hg là kim loại duy nhất tác dụng được với S ở điều kiện thường.
Fe + S to→ FeS
Hg + S to→ HgS
V. Kim loại tác dụng với dung dịch acid

VI. Kim loại tác dụng với nước và dung dịch muối
a. Tác dụng với nước
Những kim loại có tính khử mạnh như Na, K, Ca, … khử H2O dễ dàng ở nhiệt độ thường
2Na + 2H2O → 2NaOH + H2
b. Tác dụng với nước
Những kim loại có tính khử mạnh như Na, K, Ca, … khử H2O dễ dàng ở nhiệt độ thường
2Na + 2H2O → 2NaOH + H2

