I. Vị trí, cấu tạo và tính chất vật lý của chromium
1. Vị trí và cấu tạo của chromium
- Thuộc nhóm VIB, chu kì 4, số thứ tự 24, là kim loại chuyển tiếp.
- Cấu hình electron: 1s22s22p63s23p63d54s1
- Số oxi hóa: +1 đến + 6 (số oxi hóa bền: +2, +3, +6)
2. Tính chất vật lý của chromium
- Màu trắng ánh bạc, cứng nhất trong tất cả các kim loại.
- Khối lượng riêng lớn, khó nóng chảy.
II. Tính chất hóa học của chromium
Ở nhiệt độ thường chromium rất trơ. Khi đun nóng nó tác dụng tốt hơn, chromium có tính khử.
1. Tác dụng với phi kim
Giống như aluminium (Al), trong không khí, chromium tạo ra màng mỏng chromium (III) oxide bền vững bảo vệ.
4Cr + 3 O2 2 Cr2O3
2Cr + 3Cl2 2CrCl3
2. Tác dụng với nước
Chromium không tác dụng với nước ở điều kiện thường do có lớp màng oxide mỏng, bền bảo vệ. Vì vậy người ta thường mạ chromium lên sắt để bảo vệ sắt không bị ăn mòn và dùng chromium để chế tạo thép không gỉ.
3. Tác dụng với dung dịch acid
a. Với acid HCl, H2SO4 loãng tạo muối Cr(II)
Cr + 2HCl → CrCl2 + H2
b. Với acid H2SO4 đặc nóng, HNO3 đặc nóng tạo muối Cr(III)
2Cr + 6H2SO4 (đặc) Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3 (đặc) Cr(NO3)3 + 3NO2 + 3H2O
Chú ý: Chromium bị thụ động hóa trong H2SO4 đặc nguội và HNO3 đặc, nguội.
4. Tác dụng với dung dịch muối
Chromium trực tiếp đẩy kim loại yếu hơn ra khỏi dung dịch muối.
Cr + 2AgNO3 → Cr(NO3)2 + 2Ag
III. Ứng dụng của chromium
- Dùng mạ các chi tiết máy.
- Sản xuất thép chromium:
+ Thép có chứa 18% Cr là thép không gỉ (inox).
+ Thép chứa từ 25-30% Cr có tính siêu cứng dù ở nhiệt độ cao.
IV. Hợp chất của Chromium (II)
1. Chromium (II) oxide - CrO
- CrO là oxide base: CrO + 2HCl → CrCl2 + H2
- CrO có tính khử, để lâu trong không khí bị oxi hóa thành Cr2O3
2. Chromium (II) hydroxide - Cr(OH)2
- Là chất rắn màu vàng
- Có tính khử, trong không khí dễ bị oxi hóa thành Cr(OH)3
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Cr(OH)2 là base: Cr(OH)2 + 2HCl → CrCl2 + 2H2O
3. Muối chromium (II)
Muối chrom (II) có tính khử mạnh: 2CrCl2 + Cl2 → 2CrCl3
V. Hợp chất của chromium (III)
1. Chromium (III) oxide - Cr2O3
- Là oxide lưỡng tính, tan trong acid và kiềm đặc
- Cr2O3 được dùng để tạo màu lục cho đồ sứ, đồ thủy tinh.
2. Chromium (III) hydroxide - Cr(OH)3
Cr(OH)3 là hydroxide lưỡng tính, tan được trong dung dịch acid và dung dịch kiềm
Cr(OH)3 + NaOH → Na[Cr(OH)4]
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
3. Muối chromium (III)
- Muối chromium(III) có tính oxi hóa và tính khử.
- Trong môi trường acid, muối chromium (III) có tính oxi hóa và dễ bị khử thành muối chromium (II)
2Cr3+ + Zn → 2Cr2+ + Zn
- Trong môi trường kiềm, muối chromium (III) có tính khử
2Cr3+ + 3Br2 + 16OH- → 2CrO42- + 6Br- + 8H2O
- Phèn chromium (III) potasssium sulfate, CTHH: K2SO4.Cr2(SO4)3.24H2O có màu xanh tím, dùng để thuộc da, làm chất cầm màu.
VI. Hợp chất của chromium (VI)
1. Chromium (VI) oxide - CrO3
- CrO3 là chất rắn, màu đỏ thẫm.
- CrO3 có tính oxi hóa rất mạnh. Một số chất như S, P, C, NH3, C2H5OH,… bốc cháy khi tiếp xúc với CrO3
2CrO3 + 2NH3 → Cr2O3 + N2 + 3H2O
- CrO3 là oxide acid, tác dụng với nước tạo thành hỗn hợp acid
CrO3 + H2O → H2CrO4 (chromic acid)
2CrO3 + H2O → H2Cr2O7 (dichromic acid)
2. Muối chromate và dichromate
- Muối chromate (CrO42-) có màu vàng, muối dichromate (Cr2O72-) có màu da cam.
- Muối chromate và dichromate có thể chuyển hóa lẫn nhau theo môi trường:
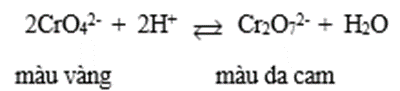
Khi thêm dung dịch acid vào muối chromate (màu vàng) sẽ tạo thành dichromate (màu da cam). Ngược lại, khi thêm dung dịch kiềm vào muối dichromate, sẽ tạo thành chromate.
- Muối chromate và dichromate có tính oxi hóa mạnh, đặc biệt trong môi trường acid.
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O

