I. Tính base của amine
1. Cấu trúc phân tử của ammonia và các amine

Trên nguyên tử N đều có cặp electron tự do nên ammonia và các amine đều dễ dàng nhận proton. Vì vậy ammmonia và các amine đều có tính base.
2. So sánh lực base
- Gốc đẩy electron (gốc no) làm tăng tính base, gốc hút electron (gốc không no) làm giảm tính base.
p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
- Amine có càng nhiều gốc đẩy e thì tính base càng mạnh, amine có càng nhiều gốc hút e thì tính base càng yếu.
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
Bài tập áp dụng: Tính base của methylamine mạnh hơn anilin vì
A. Nhóm methyl làm tăng mật độ electron của nguyên tử nitrogen, nhóm phenyl làm giảm mật độ electron của nguyên tử nitrogen.
B. Nhóm methyl làm tăng mật độ electron của nguyên tử nitrogen.
C. Nhóm methyl làm giảm mật độ electron của nguyên tử nitrogen, nhóm phenyl làm tăng mật độ electron của nguyên tử nitrogen.
D. Phân tử khối của methylamine nhỏ hơn.
Lời giải: Tính base của amine do cặp e chưa liên kết của nguyên tử nitrogen. Mật độ e trên nguyên tử nitrogen càng tăng thì tính base càng mạnh và ngược lại. Nhóm methyl là nhóm đẩy e nên làm tăng mật độ e của nguyên tử nitrogen, còn nhóm phenyl là nhóm hút e nên làm giảm mật độ e của nguyên tử nitrogen.
Đáp án: A
3. Chất chỉ thị màu
- Dung dịch methylamine và đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphthalein do có tính base mạnh hơn ammonia.
- Dung dịch của anilin và các amine thơm không làm đổi màu quỳ tím và phenolphthalein.

Bài tập áp dụng: Dung dịch chất nào sau đây làm quỳ tính chuyển sang màu xanh?
A. Anilin.
B. Ethylamine.
C. ammonium chloride (NH4Cl).
D. p-nitroanilin.
Lời giải:
+ Anilin không làm đổi màu quỳ.
+ Ethylamine có tính base mạnh hơn ammonia → làm quỳ tím chuyển màu xanh
+ ammonium chloride (NH4Cl) là muối của base yếu và acid mạnh → làm quỳ chuyển màu đỏ
+ p-nitroanilin không làm đổi màu quỳ
Đáp án: B
II. Phương pháp giải bài tập đốt cháy amin
1. Phản ứng tổng quát :CnH2n+2-2k+aNa + $\dfrac{6n+2-2k+a}{4}$O2 $\xrightarrow{\,{{t}^{o}}}$ nCO2 + $\dfrac{2n+2-2k+a}{2}$H2O + $\dfrac{a}{2}$N2 (1)
- Amin no mạch hở có công thức CnH2n+2+tNt
CnH2n+2+tNt + $\dfrac{6n+2+t}{4}$O2 $\xrightarrow{\,{{t}^{o}}}$ nCO2 + $\dfrac{2n+2+t}{2}$H2O + $\dfrac{t}{2}$N2 (1)
a mol → an mol → $a.\dfrac{2n+2+t}{2}$
$\,\to \text{ }{{n}_{amin}}=\dfrac{{{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}}{1+\dfrac{t}{2}}$
2. Phương pháp giải
- Với amin no, đơn chức, mạch hở có :
n amin = $\dfrac{{{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}}{1,5}$ ; ${{n}_{amin}}=\text{ }2{{n}_{{{N}_{2}}}}\text{;}\,\,\,\text{ }C\text{ }=\text{ }\dfrac{{{n}_{C{{O}_{2}}}}}{{{n}_{amin}}}\text{;}\,\,\text{ }H\text{ }=\text{ }\dfrac{2{{n}_{{{H}_{2}}O}}}{{{n}_{amin}}}$
- Với amin đơn chức có: ${{n}_{amin}}=2{{n}_{{{N}_{2}}}}$
- Với amin no 2 chức: ${{n}_{{{H}_{2}}O}}\text{ }-{{n}_{C{{O}_{2}}}}=2{{n}_{amin}}=2{{n}_{{{N}_{2}}}}$
Khi đốt cháy 1 amin ngoài không khí thì:
\({{n}_{{{N}_{2}}}}\)sau phản ứng = \({{n}_{{{N}_{2}}}}\)sinh ra từ phản ứng đốt cháy amin + \({{n}_{{{N}_{2}}}}\)có sẵn trong không khí
- Sử dụng định luật bảo toàn nguyên tố
- Đối với bài toán đốt cháy hỗn hợp các amin sử dụng công thức trung bình.
- Đối với bài tập đốt cháy amin bằng hỗn hợp O2 và O3 thì nên quy đổi hỗn hợp thành O.
III. Phương pháp giải bài tập amin phản ứng với axit và dung dịch muối
1. Amin tác dụng với axit sinh ra muối amoni
CH3NH2 + HCl → CH3NH3Cl
Metylamoni clorua
2CH3CH2NH2 + H2SO4 → (CH3CH2NH3)2SO4
Etylamoni sunfat
C6H5NH2 + HCl → C6H5NH3Cl
Phenylamoni clorua
Vì amin là những bazơ yếu nên các muối của amin dễ dàng tác dụng với kiềm mạnh giải phóng amin (tương tự NH3)
CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O
Phương pháp giải
- Sử dụng công thức của amin dạng RNH2
- Ta có : số nhóm chức amin = $\dfrac{{{n}_{{{H}^{+}}}}}{{{n}_{a\min }}}$
- Sử dụng tăng giảm khối lượng: nHCl = $\dfrac{{{m}_{m'}}-{{m}_{a\min }}}{36,5}$
- Sử dụng bảo toàn khối lượng : mmuối = mamin + maxit
2. Amin tác dụng với dung dịch muối của một số kim loại tạo ra kết tủa hiđroxit tương ứng
3CH3NH2 + FeCl3 + 3H2O $\xrightarrow{{}}$ Fe(OH)3 + 3CH3NH3Cl
3CH3CH2NH2 + AlCl3 + 3H2O $\xrightarrow{{}}$ Al(OH)3 + 3CH3CH2NH3Cl
+ amin không hòa tan được hiđroxit lưỡng tính (Al(OH)3, Zn(OH)2, …)
+ amin có khả năng tạo phức tương tự NH3
+ anilin và những amin thơm không có phản ứng này
Phương pháp giải:
- Đặt công thức amin là RNH2.
- Chú ý tỉ lệ số mol của amin và các muối cũng như kết tủa sinh ra.
IV. Phương pháp giải bài tập amin phản ứng với HNO2 và phản ứng thế ở nhân thơm của anilin
1. Amin tác dụng với dung dịch HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
Ví dụ : C2H5NH2 + HONO → C2H5OH + N2 + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni:
C6H5NH2 + HONO + HCl $\xrightarrow{0-{{5}^{o}}C}$ C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
- Muối điazoni có vai trò quan trọng trong tổng hợp hữu cơ, đặc biệt là tổng hợp phẩm nhuộm azo.
2. Phản ứng thế ở nhân thơm của anilin
Giải thích : Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom.
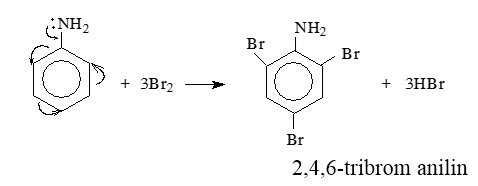
+ Phản ứng này dùng nhận biết anilin vì tạo ra kết tủa trắng 2, 4, 6-tribromanilin.
+ Amin không no có phản ứng cộng làm mất màu dung dịch brom tương tự anken, ankin, …

