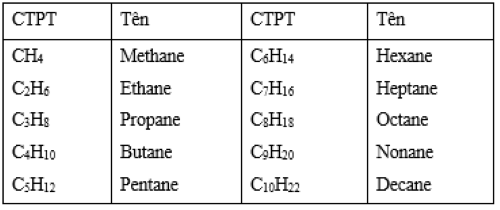
I. Tên của 10 alkane mạch thẳng đầu dãy
Tên của 10 alkane mạch thẳng đầu dãy = Tên mạch chính + ane
II. Tên các nhóm alkyl
1. Tên gốc alkyl mạch thẳng
- Khi phân tử alkane bị mất đi 1 nguyên tử H thì tạo thành gốc alkyl.
- Tên của gốc alkyl được đọc tương tự như tên alkane nhưng thay đuôi “ane” bằng đuôi “yl”
Ví dụ:
CH4 (Methane) - H→ - H−−→ –CH3 (Methyl)
C2H6 (Ethane) - H→ - H−−→ –C2H5 (Ehane)
CH3 – CH2 – CH2 – CH2 –: n-pentyl
2. Tên gốc alkyl mạch nhánh (tên thường)
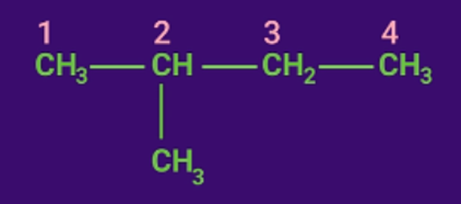
Khi 1 nhóm –CH3 phân nhánh ở vị trí carbon số 2 thì đọc là iso. Khi đọc phải tính tất cả các nguyên tử C trong gốc alkyl.
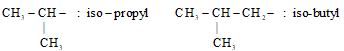
* Tên 1 số gốc alkyl khác:
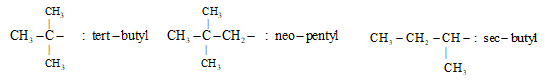
III. Tên thay thế của alkane
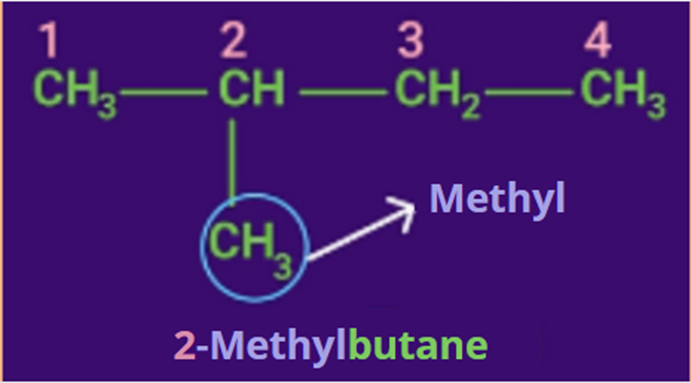
Bước 1: Xác định mạch chính.
Chọn mạch C dài nhất và có nhiều nhánh nhất làm mạch chính.
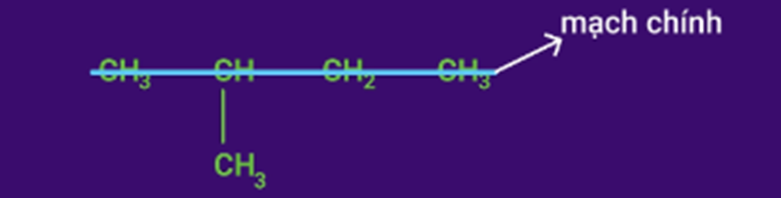
Bước 2: Đánh số.
Đánh số thứ tự các nguyên tử C mạch chính bắt đầu từ phía gần nhánh hơn.
+ Nếu có nhiều nhánh giống nhau thì phải nêu đầy đủ vị trí của các nhánh và phải thêm các tiền tố đi (2), tri (3), tetra (4) trước tên nhánh.
+ Nếu có nhiều nhánh khác nhau thì tên nhánh được đọc theo thứ tự trong bảng chữ cái (ethyl, methyl, propyl…).
Bước 3: Gọi tên
Tên alkane được gọi theo thứ tự:
Tên alkane = Số chỉ vị trí nhánh + tên nhánh + tên mạch chính + ane
Tên mạch chính: tên mạch carbon + "ane".
Tên mạch nhánh: tên mạch carbon + "yl".
Lưu ý:
- Giữa số và số có dấu phẩy, giữa số và chữ có dấu gạch “ – ”
- Nếu alkane có chứa đồng thời các nhóm thế là halogen, nitro, alkyl thì ưu tiên đọc nhóm halogen trước, sau đó đến nhóm nitro, cuối cùng là nhóm alkyl. Đối với các nhóm thế cùng loại, thứ tự đọc theo α, b, ví dụ trong phân tử có nhóm CH3- và C2H5- thì đọc ethyl trước và methyl sau.
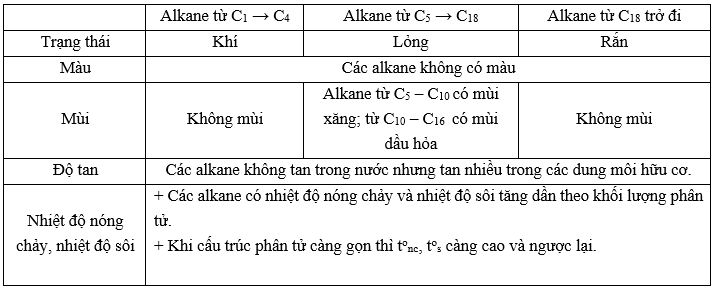
IV. Tính chất vật lý của alkane
V. Phương pháp giải bài tập phản ứng thế halogen của ankan
* Nhận xét chung
- Do trong phân tử chỉ có các liên kết đơn là các liên kết bền nên ở điều kiện thường các ankan tương đối trơ về mặt hóa học. Ankan không bị oxi hóa bởi các dung dịch H2SO4 đặc, HNO3, KMnO4…
- Khi có as, to, xt thì ankan tham gia các phản ứng thế, tách và oxi hóa.
1. Phản ứng thế halogen (phản ứng halogen hóa)
- Thường xét phản ứng với Cl2, Br2
- Dưới tác dụng của ánh sáng, các ankan tham gia phản ứng thế halogen. Các nguyên tử H có thể lần lượt bị thế đến hết bằng các nguyên tử halogen.
CH4 + Cl2 as→as−→ CH3Cl + HCl
CH3Cl + Cl2 as→as−→ CH2Cl2 + HCl
CH2Cl2 + Cl2 as→as−→ CHCl3 + HCl
CHCl3 + Cl2 as→as−→ CCl4 + HCl
2. Quy tắc thế
Khi tham gia phản ứng thế, nguyên tử halogen sẽ ưu tiên tham gia thế vào nguyên tử H của C bậc cao hơn (có ít H hơn).
Ví dụ : CH3–CH2–CH3 + Br2 as→as−→ CH3–CHBr–CH3 + HBr
+ Chỉ có Cl2, Br2 tham gia phản ứng; I2, F2 không tham gia phản ứng.
+ Số lượng nguyên tử H bị thay thế phụ thuộc vào tỉ lệ mol ankan và halogen.
+ Nguyên tử H của Cbậc cao dễ bị thay thế hơn nguyên tử H của Cbậc thấp.
3. Phương pháp giải bài tập thế halogen
- Bước 1 : Viết phương trình phản ứng của ankan với Cl2 hoặc Br2. Nếu đề bài không cho biết sản phẩm thế là monohalogen, đihalogen,… thì ta phải viết phản ứng ở dạng tổng quát :
CnH2n+2+xBr2as,to→CnH2n+2−xBrx+xHBrCnH2n+2+xBr2as,to−−−→CnH2n+2−xBrx+xHBr
hoặc CnH2n+2+xCl2as→CnH2n+2−xClx+xHClCnH2n+2+xCl2as−→CnH2n+2−xClx+xHCl
- Bước 2 : Tính khối lượng mol của sản phẩm thế hoặc khối lượng mol trung bình của hỗn hợp sản phẩm để tìm số nguyên tử cacbon trong ankan hoặc mối liên hệ giữa số cacbon và số nguyên tử clo, brom trong sản phẩm thế, từ đó xác định được số nguyên tử cacbon và số nguyên tử clo, brom trong sản phẩm thế. Suy ra công thức cấu tạo của ankan ban đầu và công thức cấu tạo của các sản phẩm thế.
VI. Phương pháp giải bài tập phản ứng oxi hóa ankan
1. Phản ứng cháy (oxi hóa hoàn toàn)
CnH2n+2+3n + 12O2to→nCO2+(n+1)H2OCnH2n+2+3n + 12O2to→nCO2+(n+1)H2O
- Đốt cháy ankan luôn có nH2OnH2O> nCO2nCO2và nankan = nH2OnH2O – nCO2nCO2, do đó khi đốt cháy hiđrocacbon bất kì thu được nH2O>nCO2nH2O>nCO2thì đó là ankan
- Số C trong ankan hay số C trung bình của hỗn hợp các ankan = nCO2nankan=nCO2nH2O−nCO2nCO2nankan=nCO2nH2O−nCO2
- Số mol O2 phản ứng =2.nCO2+nH2O22.nCO2+nH2O2
- Bảo toàn khối lượng : mankan+ mO2= mCO2+ mH2O hoặc mankan= mC+ mH= 12nCO2+ 2nH2O
* Khi gặp bài tập liên quan đến hỗn hợp các ankan thì nên sử dụng phương pháp trung bình: Thay hỗn hợp các ankan bằng một ankan C¯nH2¯n+2dựa vào giả thiết để tính toán số C trung bình (giá trị ˉn) rồi căn cứ vào tính chất của giá trị trung bình để suy ra kết quả cần tìm.
2. Phản ứng oxi hóa không hoàn toàn
- Ankan có thể bị oxi hóa không hoàn toàn tạo ra các sản phẩm khác nhau.
Ví dụ : CH4 + O2 600-800oC, NO→HCHO + H2O
RCH2 CH2R +O2 to, Mn2+→RCOOH + RCOOH+ H2O
VII. Điều chế alkane
1. Trong phòng thí nghiệm
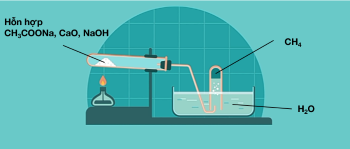
a. Phản ứng vôi tôi xút
CnH2n+1COONa+NaOHCaO,to→CnH2n+2+Na2CO3
Tổng quát:
CnH2n+2-x(COONa)x + xNaOH → CnH2n+2 + xNa2CO3 (CaO, t0)
Ví dụ:
CH3COONa+NaOHCaO,to→CH4+Na2CO3
b. Cộng H2 vào hợp chất không no
CnH2n+2−2m+mH2Ni,to→CnH2n+2
2. Điều chế trong công nghiệp
- Chưng cất phân đoạn dầu mỏ.
- Đi từ khí thiên nhiên và khí dầu mỏ.
- Cracking alkane:
CnH2n+2xt, to→CmH2m+2+CkH2k

3. Điều chế methane
- Từ muối của carboxylic acid:
CH3COONa+NaOHCaO,to→CH4+Na2CO3
- Từ hợp chất cacbua kim loại:
Al4C3+12H2O→3CH4+4Al(OH)3↓
- Tổng hợp:
C+2H2Ni→500oCCH4
CO+3H2xt,to→CH4+H2O
VIII. Ứng dụng của alkane
- Dùng làm nhiên liệu (CH4 dùng trong đèn xì để hàn, cắt kim loại).
- Dùng làm dầu bôi trơn.
- Dùng làm dung môi.
- Để tổng hợp nhiều chất hữu cơ khác: CH3Cl, CH2Cl2, CCl4, CF2Cl2,…
- Đặc biệt từ CH4 điều chế được nhiều chất khác nhau: hỗn hợp CO + H2, ammonia, CH≡CH, rượu methylic, aldehyde fromic.


