I. Tính chất vật lý của chlorine
Ở điều kiện thường:
- Chlorine là chất khí độc, màu vàng lục, mùi xốc, nặng hơn không khí.
- Khí chlorine tan vừa phải trong nước tạo thành nước chlorine màu vàng nhạt.
- Chlorine tan nhiều trong các dung môi hữu cơ.

II. Chlorine tác dụng với kim loại
- Cấu hình electron của nguyên tử chlorine: 1s22s22p63s23p5
Do lớp e ngoài cùng có 7e nên chloride là phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
- Trong các hợp chất, chloride thường có mức oxi hóa -1; trong hợp chất với F hoặc O, chloride còn có mức oxi hóa +1; +3; +5; +7. Vì vậy trong một số phản ứng, chloride còn có tính khử.
Chlorine tác dụng với kim loại
Chloride phản ứng với hầu hết các kim loại (trừ Au và Pt) → muối chloride . Muối thu được thường ứng với mức hóa trị cao của kim loại.
20 M + n0Cl2to→2+n M−1Cln
Ví dụ:
20Na + 0Cl2to→2+1Na−1Cl
2\mathop {Fe}\limits^0 {\text{ }} + {\text{ 3}}\mathop {C{l_2}}\limits^0 \,\;\xrightarrow{{{t^o}}}\;\,\,2\mathop {Fe}\limits^{ + 3} \mathop {C{l_3}}\limits^{ - 1} (nâu\,\,đỏ)
III. Chlorine tác dụng với hydrogen
Khí chlorine tác dụng với hydrogen trong môi trường có ánh sáng mạnh (ánh sáng mặt trời hoặc ánh sáng cháy của magnesium) tạo hydrogen chloride.
\mathop {{H_2}}\limits^0 {\text{ }} + {\text{ }}\mathop {C{l_2}\,\,}\limits^0 \;\xrightarrow{{ánh{\kern 1pt} {\kern 1pt} sáng}}\;\,\,2\mathop {{\text{ }}H}\limits^{ + 1} \mathop {Cl}\limits^{ - 1} \,

Chlorine thể hiện tính oxi hóa mạnh khi tác dụng với kim loại và hydrogen.
IV. Chlorine tác dụng với nước
- Chlorine có phản ứng thuận nghịch với nước:
\mathop {C{l_2}}\limits^0 {\text{ }} + {\text{ }}{H_2}O\,\,\; \rightleftarrows \;\,\,\mathop {{\text{ }}H}\limits^{} \mathop {Cl}\limits^{ - 1} \,\,\,\, + \,\,\,H\mathop {Cl}\limits^{ + 1} O\,\,(hydrochloricacid\,\,và\,\,hypochlorousacid)
- Trong phản ứng trên, một nguyên tử Cl bị oxi hóa thành Cl+1, một nguyên tử Cl bị khử thành Cl-1. Vậy trong phản ứng trên, chloride vừa là chất khử vừa là chất oxi hóa.
- Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO→ HCl + [O]
[O] sinh ra có tính oxi hóa mạnh nên có thể dùng nước Chloride để tẩy màu hoặc sát trùng.
V. Chlorine tác dụng với dung dịch kiềm
- Nếu dung dịch kiềm loãng nguội:
{\mathop {Cl}\limits^0 _2}\; + {\text{ }}2NaOH\; \to \;Na\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}Na\mathop {Cl}\limits^{ + 1} O{\text{ }} + {\text{ }}{H_2}O
(hỗn hợp NaCl và NaClO là nước Javen)
- Nếu dung dịch kiềm đặc nóng:
3Cl2 + 6KOH \xrightarrow{{{{100}^o}C}} 5KCl + KClO3 + 3H2O
VI. Chlorine tác dụng với dung dịch muối bromide và iodide
Chloride đẩy được bromine và iodine ra khỏi dung dịch muối bromide và iodide (không đẩy được muối fluoride)
\mathop {C{l_2}}\limits^0 + {\text{ }}2Na\mathop {Br}\limits^{ - 1} {\text{ }} \to \;2Na\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}\mathop {B{r_2}}\limits^0
\mathop {C{l_2}}\limits^0 \; + {\text{ }}2K\mathop {{\text{ }}I}\limits^{ - 1} {\text{ }} \to \;\,\,2K\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}\mathop {{I_2}}\limits^0
VII. Chlorine tác dụng với các hợp chất có tính khử
Chlorine cũng thể hiện tính oxi hóa khi tác dụng với các hợp chất có tính khử:
3\mathop {C{l_2}}\limits^0 \; + {\text{ }}2\mathop {{\text{ }}N}\limits^{ - 3} {H_3}\; \to \;\mathop {{N_2}}\limits^0 + {\text{ }}6H\mathop {Cl}\limits^{ - 1}
(phản ứng dùng để khử độc khí chloride trong phòng thí nghiệm)
4\mathop {C{l_2}}\limits^0 \; + {\text{ }}{H_2}\mathop S\limits^{ - 2} {\text{ }} + {\text{ }}4{H_2}O\;\,\, \to \,\,\;8H\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}{H_2}\mathop S\limits^{ + 6} {O_4}
VIII. Trạng thái tự nhiên và ứng dụng của chlorine
1. Trạng thái tự nhiên
Chloride chủ yếu tồn tại ở dạng muối chloride, quan trọng nhất là NaCl có trong nước biển và đại dương. KCl cũng khá phổ biến, nó có trong khoáng vật carnalite KCl.MgCl2.6H2O và sylvinite NaCl.KCl.

2. Ứng dụng
- Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch.
- Tẩy trắng vải, sợi, giấy...
- Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ (nhựa PVC, cao su, chất dẻo, chất màu…) và chất vô cơ.
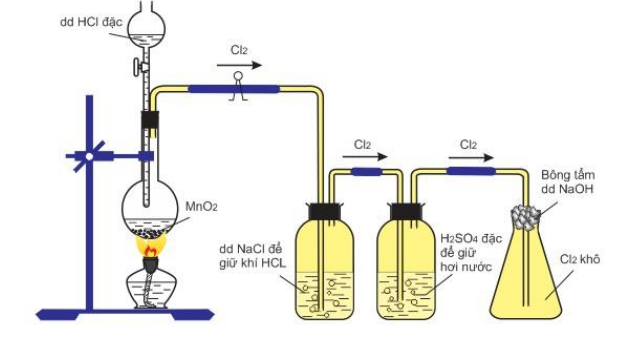
IX. Điều chế chlorine
1. Trong phòng thí nghiệm
Cho HX tác dụng với các chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O