I. Vị trí, cấu hình electron nguyên tử lưu huỳnh
- S (Z = 16): 1s22s22p63s23p4
- Vị trí: ô thứ 16, chu kì 3, nhóm VIA
=> Lớp ngoài cùng có 6 electron trong đó có 2 electron độc thân.
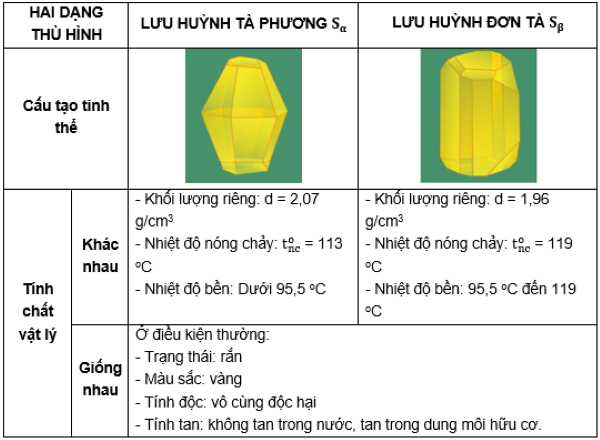
II. Tính chất vật lý của lưu huỳnh
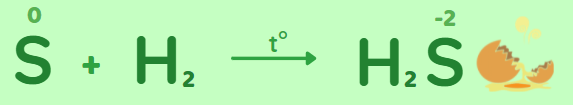
III. Lưu huỳnh tác dụng với hydrogen
- Cấu hình electron của S có 6e ở lớp ngoài cùng → dễ nhận 2e thể hiện tính oxi hóa mạnh. Tính oxi hóa của S yếu hơn so với O.
- Các mức oxi hóa có thể có của S: -2, 0, +4, +6. Ngoài tính oxi hóa, S còn có tính khử.
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với hydrogen
Ở nhiệt độ cao lưu huỳnh tác dụng với hydrogen tạo thành khí hydro sulfide (mùi trứng thối).
IV. Lưu huỳnh tác dụng với kim loại
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với nhiều kim loại → muối sulfide (trong đó kim loại thường chỉ đạt đến hóa trị thấp, hầu hết xảy ra ở nhiệt độ cao).
\(2\mathop {Na}\limits^0 {\text{ }} + {\text{ }}\mathop S\limits^0 \; \to \;\mathop {N{a_2}}\limits^{ + 1} \mathop S\limits^{ - 2} \)
\(\mathop {Hg}\limits^0 {\text{ }} + {\text{ }}\mathop S\limits^0 \; \to \;\mathop {Hg}\limits^{ + 2} \mathop S\limits^{ - 2} \;\)
(phản ứng xảy ra ở ngay nhiệt độ thường nên thường dùng S khử độc Hg)

Lưu huỳnh được dùng để gom thủy ngân khi bị vỡ nhiệt kế, tránh gây nguy hiểm vì thủy ngân vô cùng độc hại và ảnh hưởng tới sức khỏe
Một số muối sulfide có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sulfide.
V. Tính khử của lưu huỳnh
- Lưu huỳnh cháy trong oxygen tạo ngọn lửa màu xanh lam:
$\mathop {S\,}\limits^0 \, + \,\,\mathop {{O_2}}\limits^0 \,\,\xrightarrow{{{t^o}}}\,\,\,\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} $
- Lưu huỳnh tác dụng với halogene:
\[\mathop S\limits^0 \, + \,3{F_2}\,\xrightarrow{{{t^o}}}\,\mathop S\limits^{ + 6} {F_6}\]
- Lưu huỳnh tác dụng với các chất có tính oxi hóa mạnh như H2SO4 đặc, HNO3, KClO3…
$3\mathop S\limits^0 \, + \,2KCl{O_3}\,\xrightarrow{{{t^o}}}\,3\mathop S\limits^{ + 4} {O_2}\, + \,2KCl$
Các phản ứng hóa học của lưu huỳnh đều phải có điều kiện nhiệt độ, trừ phản ứng giữa lưu huỳnh và thủy ngân.
VI. Trạng thái tự nhiên của lưu huỳnh
- Đơn chất (chủ yếu): mỏ lưu huỳnh
- Hợp chất:
+ Muối sunfua: FeS2 (quặng pyrite), FeCuS2 (chalcopyrite)…
+ Muối sunfat: CaSO4.2H2O (thạch cao sống), Na2SO4.10H2O…
+ H2S và protein.
VII. Ứng dụng và sản xuất lưu huỳnh
1. Ứng dụng
- 90% lượng lưu huỳnh dùng để điều chế H2SO4.
- 10% lượng lưu huỳnh dùng để lưu hóa cao su, chế tạo diêm, dược phẩm, phẩm nhuộm, tẩy trắng, chống nấm mốc…

2. Sản xuất
Sử dụng phương pháp Frasch: dùng hệ thống thiết bị nén nước siêu nóng (170 oC) vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên mặt đất. Sau đó lưu huỳnh được tách khỏi các tạp chất.

