I. Lí thuyết chung về ankin
I. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
1. Đồng đẳng
- Ankin là hiđrocacbon mạch hở chứa 1 liên kết ba C≡C trong phân tử.
- Ankin đơn giản nhất là C2H2 (CH≡CH)
- Công thức phân tử chung của dãy đồng đẳng ankin là: CnH2n-2 (n ≥ 2).
2. Đồng phân
- Hiện tượng đồng phân là do mạch C khác nhau và do vị trí nối ba khác nhau.
- Ankin từ C4 trở đi có đồng phân vị trí liên kết bội, từ C5 trở đi có thêm đồng phân mạch C
Ví dụ: ankin C4H6 có 2 đồng phân: CH≡C–CH2–CH3 và CH3–C≡C–CH3
Ankin C5H8 có 3 đồng phân: CH≡C–CH2–CH2–CH3 ; CH3–C≡C–CH2–CH3 ; CH≡C–CH(CH3)–CH3
* Ankin không có đồng phân hình học
3. Danh pháp
Cách gọi tương tự anken nhưng thay “en” bằng đuôi “in”.
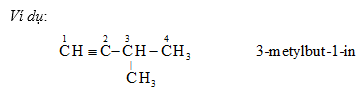
II. TÍNH CHẤT VẬT LÝ
- Trạng thái: C2 → C4 là chất khí; C5 → C16 : chất lỏng; C17 trở lên: chất rắn.
- tsôi, tnc : Tăng khi tăng M tăng (lớn hơn tsôi, tnc của anken có cùng số C)
- Độ tan: Không tan trong nước nhưng tan được trong một số dung môi hữu cơ.
- Khối lượng riêng: nhỏ hơn khối lượng riêng của nước nhưng lớn hơn khối lượng riêng của anken tương ứng.
III. ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế axetilen
a. Trong công nghiệp: đi từ metan
2CH4 $\xrightarrow[l\ln ]{{{1500}^{o}}C}$ C2H2 + 3H2 (lln: làm lạnh nhanh)
b. Trong PTN: Thuỷ phân canxi cacbua
CaC2 + H2O → Ca(OH)2 + C2H2↑
2. Ứng dụng của ankin
Chỉ có axetilen có nhiều ứng dụng quan trọng.
- Để thắp sáng (khí đất đèn).
- Dùng trong đèn xì để hàn, cắt kim loại.
- Dùng để tổng hợp nhiều chất hữu cơ khác nhau: anđehit axetic, cao su tổng hợp (policlopren), các chất dẻo và các dung môi,…
II. Phương pháp giải bài tập phản ứng oxi hóa ankin và hiđrocacbon
1. Phản ứng oxi hóa không hoàn toàn:
- Ankin có khả năng làm mất màu dung dịch KMnO4 tạo thành nhiều sản phẩm khác nhau.
2. Phản ứng oxi hóa hoàn toàn:
${{C}_{n}}{{H}_{2n-2}}+\,\frac{3n-1}{2}{{O}_{2}}\xrightarrow{{{t}^{o}}}nC{{O}_{2}}+(n-1){{H}_{2}}O$
=> Đốt cháy ankin thu được ${{n}_{{{H}_{2}}O}}<{{n}_{C{{O}_{2}}}}$và ${{n}_{ankin}}=\text{ }{{n}_{C{{O}_{2}}}}\text{ - }{{n}_{{{H}_{2}}O}}$
* Tổng hợp phản ứng oxi hóa hoàn toàn hiđrocacbon:
Hiđrocacbon: CxHy hoặc CnH2n+2-2a ( n ≥ 1; a ≥ 0 )
Trong đó a: Độ bất bão hòa ( tổng số liên kết π và vòng no)
${{C}_{x}}{{H}_{y}}+\left( x+\frac{y}{4} \right){{O}_{2}}\xrightarrow{{{t}^{0}}}xC{{O}_{2}}+\frac{y}{2}{{H}_{2}}O$
Áp dụng các định luật bảo toàn ta có:
+ Bảo toàn khối lượng: mCxHy phản ứng + mO2 phản ứng = mCO2 + mH2O
+ Bảo toàn khối lượng hiđrocacbon: mCxHy phản ứng = 12.nCO2 + 2.nH2O
+ Bảo toàn nguyên tố O: ${{n}_{{{O}_{2}}}}={{n}_{C{{O}_{2}}}}+\dfrac{1}{2}.\,{{n}_{{{H}_{2}}O}}$
${{C}_{n}}{{H}_{2n+2-2a}}+\left( \frac{3n+1-a}{2} \right){{O}_{2}}\xrightarrow{{{t}^{0}}}nC{{O}_{2}}+(n+1-a){{H}_{2}}O$
+ Nếu ${{n}_{{{H}_{2}}O}}>{{n}_{C{{O}_{2}}}}$=> ankan: CnH2n+2 và ${{n}_{ankan}}={{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}$
+ Nếu ${{n}_{{{H}_{2}}O}}={{n}_{C{{O}_{2}}}}$=> anken hoặc xiloankan 1 vòng : CnH2n
+ Nếu ${{n}_{{{H}_{2}}O}}<{{n}_{C{{O}_{2}}}}$=> hiđrocabon có độ bất bão hòa ≥ 2. Nếu là ankin (hoặc ankađien) thì${{n}_{ankin/ankadien}}={{n}_{C{{O}_{2}}}}-{{n}_{{{H}_{2}}O}}$
III. Phương pháp giải bài tập phản ứng của ankin có nối ba đầu mạch và phản ứng đime hóa - trime hóa
I. PHẢN ỨNG ĐIME HÓA, TRIME HÓA
Phản ứng đime hóa: 2CH≡CH $\xrightarrow{xt,{{t}^{o}}}$ CH2=CH–C≡CH
Phản ứng trime hóa: 3CH≡CH $\xrightarrow{C,{{600}^{o}}C}$ C6H6 (benzen)
II. PHẢN ỨNG THẾ
- Chỉ xảy ra đối với axetilen và các ankin khác có nối ba ở cacbon đầu mạnh R – C≡CH
Tổng quát: R – C≡CH + AgNO3 + NH3 → R – C≡CAg↓ + NH4NO3
Ví dụ:
CH3 – C≡CH + AgNO3 + NH3 → CH3 – C≡CAg ↓vàng nhạt + NH4NO3
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg ↓vàng nhạt + 2NH4NO3
=> Phản ứng dùng để nhận biết ankin có nối ba đầu mạch.
- Khi cho sản phẩm thế tác dụng với axit lại giải phóng ankin:
CAg≡CAg + 2HNO3 → CH≡CH + 2AgNO3
* Phương pháp giải:
- Nếu R là gốc ankyl => phản ứng tỉ lệ 1 : 1
- Nếu R là H (CH≡CH) => phản ứng tỉ lệ 1 : 2
- Nếu hỗn hợp ankin phản ứng với dung dịch AgNO3/NH3. Gọi k = nAgNO3/NH3 / nankin
k = 1 => hỗn hợp gồm các ank-1-in
1 < k < 2 => hỗn hợp gồm C2H2 (hoặc ankin có 2 nối 3 đầu mạch) và ank-1-in
k = 2 => hỗn hợp gồm C2H2 hoặc các ankin có 2 nối 3 đầu mạch
- Sử dụng phương pháp tăng giảm khối lượng:
Mkết tủa = Mankin + 107x (x là số liên kết 3 đầu mạch với ankin khác C2H2)
=> Cứ 1 mol nguyên tử H bị thay thế bởi 1 mol nguyên tử Ag → khối lượng tăng 107 gam
- Số mol kết tủa bằng số mol hiđrocacbon phản ứng.

