I. Vị trí của nhóm halogen trong bảng tuần hoàn
- Gồm các nguyên tố fluorine (F), chlorine (Cl), bromine (Br), iodine (I) và atatin (At). Atatin không gặp trong tự nhiên, là nguyên tố phóng xạ.
- Thuộc nhóm VIIA, đứng ở cuối các chu kì, ngay trước các nguyên tố khí hiếm.
II. Cấu hình electron nguyên tử và cấu tạo phân tử nguyên tố nhóm halogen
- Cấu hình electron dạng tổng quát: ns2np5
- Do có 7 electron ở lớp ngoài cùng, chỉ còn thiếu 1 electron là đạt được cấu hình electron bền như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một đôi electron để tạo ra phân tử có liên kết cộng hoá trị không cực.

hay X – X hoặc X2 (X là kí hiệu chỉ các nguyên tố halogen)
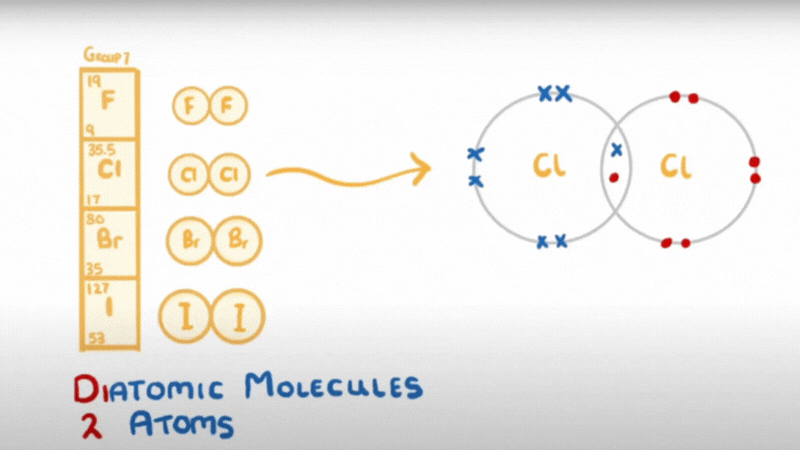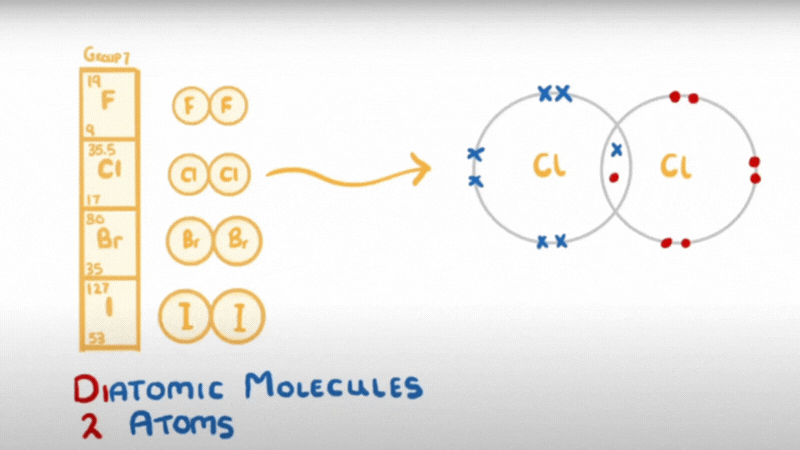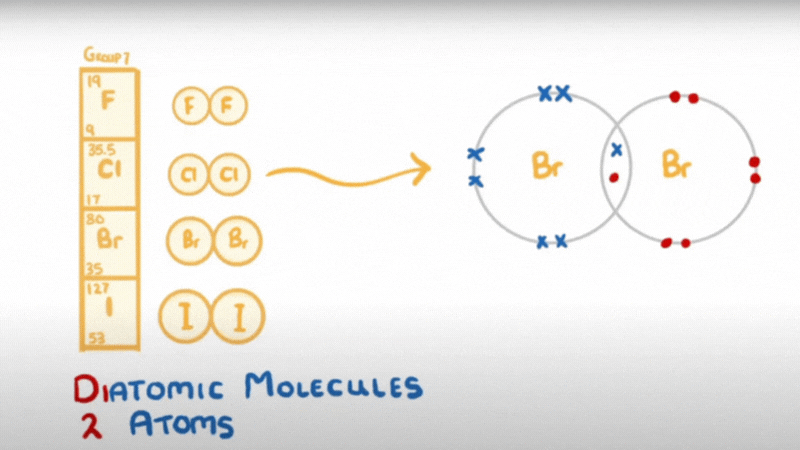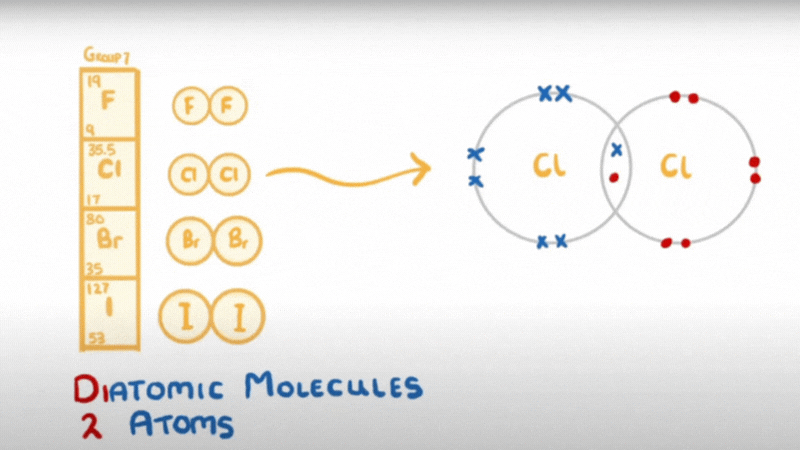
- Liên kết của phân tử X2 không bền, dễ bị tách thành 2 nguyên tử X.
- Trong phản ứng hoá học, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 eleetron, do đó tính chất hoá học cơ bản của các halogen là tính oxi hoá mạnh.
X + 1e → X−
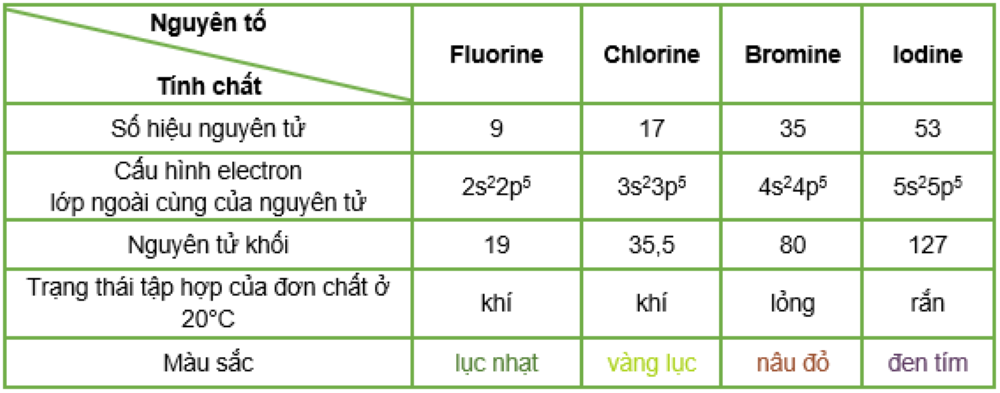
III. Một số đặc điểm của các nguyên tố nhóm halogen
IV. Sự biến đổi tính chất vật lí của các đơn chất halogen
Đi từ fluorine đến iodine:
– Trạng thái tập hợp: Từ thể khí chuyển sang thể lỏng và thể rắn.
– Màu sắc: Đậm dần.
– Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần.
- Bán kính nguyên tử tăng dần

V. Sự biến đổi độ âm điện các nguyên tố nhóm halogen
– Độ âm điện tương đối lớn.
– Đi từ fluorine đến iodine độ âm điện giảm dần.
– Fluorine có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hoá –1. Các nguyên tố halogen khác, ngoài số oxi hoá –1 còn có các số oxi hoá +1, +3, +5, +7.
VI. Sự biến đổi tính chất hoá học của các đơn chất halogen
– Vì lớp electron ngoài cùng có cấu tạo tương tự nhau (ns2np5) nên các đơn chất halogen giống nhau vể tính chất hoá học cũng như thành phần và tính chất của các hợp chất đo chúng tạo thành.
– Halogen là những phi kim điển hình. Đi từ fluorine đến iodine, tính oxi hoá giảm dần.
– Các đơn chất halogen oxi hoá được hầu hết các kim loại tạo ra muối halide, oxi hoá khí hiđro tạo ra những hợp chất khí không màu hydrogen halide. Những chất khí này tan trong nước tạo ra dung dịch hydroiodic acid (VD: HCl, HBr…)

