I. Đồng đẳng của alkene
- Khái niệm: Alkene hay olefin là hydrocarbon không no, mạch hở trong phân tử có chứa 1 liên kết đôi C=C còn lại là các liên kết đơn.
- Công thức chung của alkene: CnH2n (n ≥ 2)

II. Đồng phân của alkene
1. Đồng phân cấu tạo
- Đồng phân mạch C ( n ≥ 4)
- Đồng phân vị trí liên kết đôi (n ≥ 4)
2. Đồng phân hình học
- Điều kiện:
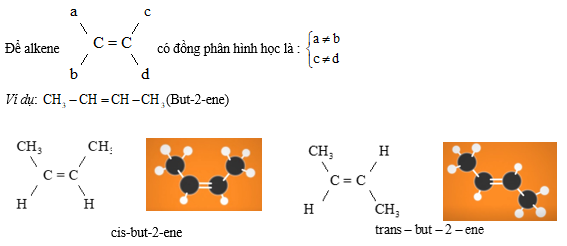
Các bước viết đồng phân alkene
Bước 1: Viết tất cả các đồng phân cấu tạo
+) Đồng phân mạch không nhánh
- Đặt liên kết đôi đầu mạch.
- Di chuyển liên kết đôi đến lần lượt các vị trí không trùng nhau.
+) Đồng phân mạch phân nhánh
- Cố định vị trí liên kết đôi, di chuyển nhánh.
- Cố định nhánh, di chuyển vị trí liên kết đôi.
Bước 2: Viết tất cả các đồng phân hình học (cis – trans)
Bước 3: Cách tính số đồng phân
- Đếm tất cả các đồng phân cấu tạo.
- Tính số đồng phân hình học.
III. Danh pháp của alkene
1. Mạch C không nhánh
Tên mạch C + số chỉ vị trí nối đôi + ene
2. Mạch C có nhánh
Số chỉ vị trí nhánh – tên nhánh + Tên mạch chính + vị trí nối đôi + ene
Chú ý:
+ Chọn mạch chính là mạch chứa liên kết đôi dài nhất nếu cũng cùng chứa liên kết đôi và có cùng số cacbon thì chọn mạch nào có nhiều nhánh hơn.
+ Đánh số từ phía gần liên kết đôi hơn.
Ví dụ:
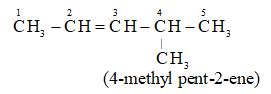
IV. Tính chất vật lý của alkene
Ở điều kiện thường:
- Các alkene từ C2H4 là chất khí, từ C5H10 trở đi là chất lỏng hoặc chất rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng của phân tử khối.

- Các alkene đều nhẹ hơn nước và không tan trong nước.
V. Phương pháp giải bài tập phản ứng oxi hóa anken
1. Phản ứng oxi hóa hoàn toàn
CnH2n+3n2O2→nCO2+nH2O
- Đốt cháy hiđrocacbon mạch hở thu được nCO2=nH2O => hiđrocacbon là anken
Đốt cháy ankan thu được nankan=nH2O−nCO2
Đốt cháy anken thu được: nCO2=nH2O
=> Nếu đốt cháy hỗn hợp ankan và anken thì nankan= nH2O - nCO2
2. Phản ứng oxi hóa không hoàn toàn (phản ứng với dung dịch KMnO4)
- Anken tác dụng với oxi trong điều kiện oxi thiếu, ngoài sản phẩm là CO2 thì ta còn thu được các sản phẩm khác như C, anđehit, axit
- Phản ứng với dung dịch KMnO4:
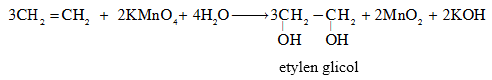
PTTQ: 3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2MnO2 + 2KOH
Lưu ý:
+ Phản ứng làm mất màu tím của dung dịch KMnO4 và tạo kết tủa đen MnO2 => dùng để nhận biết anken
+ Cân bằng phản ứng: 3, 2, 4, 3, 2, 2
VI. Phương pháp giải bài tập phản ứng cộng của anken
Liên kết đôi C=C gồm 1 liên kết δ và 1 liên kết π. Liên kết π kém bền hơn liên kết δ nên dễ bị phân cắt hơn, gây nên tính chất hóa học đặc trưng của anken: dễ tham gia phản ứng cộng tạo thành hợp chất no tương ứng.
1. Cộng H2
CnH2n(anken)+H2to, Ni→CnH2n+2(ankan)
Ví dụ CH2=CH2+H2to, Ni→CH3−CH3
2. Cộng halogen (Br2, Cl2)
CnH2n + Br2 → CnH2nBr2
(vàng nâu) (không màu)
Ví dụ: CH3−CH=CH2+Br2→CH3−CHBr−CH2Br
* Phản ứng dùng để nhận biết anken
3. Cộng HX (X là OH, Cl, Br,...)
Ví dụ: CH2=CH2+HCl→CH3−CH2Cl
CH2=CH2+H2OH+,t0→CH3−CH2OH
Đối với các anken bất đối xứng khi tham gia phản ứng cộng HX có thể sinh ra hỗn hợp sản phẩm.
Quy tắc cộng Mac-côp-nhi-côp: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (hay phần tử mang điện dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện tích âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít h hơn).
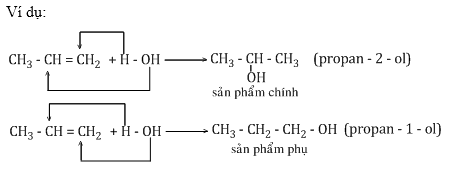
Kết luận:
- Anken đối xứng + tác nhân bất đối xứng => 1 sản phẩm
- Anken bất đối xứng + tác nhân đối xứng => 1 sản phẩm
- Anken bất đối xứng + tác nhân bất đối xứng => 2 sản phẩm
* Phương pháp giải
1. Phản ứng cộng hợp H2 (Ni, to)
Tổng quát: (X){ankenH2→H⩽
+ Tùy thuộc vào hiệu suất phản ứng mà tổng hợp Y có thành phần khác nhau.
+ Theo định luật bảo toàn khối lượng: {{m}_{X}}={{m}_{Y}}\Rightarrow \frac{{{{\bar{M}}}_{X}}}{{{{\bar{M}}}_{Y}}}=\frac{{{n}_{Y}}}{{{n}_{X}}}
+ nhỗn hợp khí giảm = {{n}_{{{H}_{2}}}}(phản ứng)
+ Đốt cháy hoàn toàn hỗn hợp Y giống như đốt cháy hoàn toàn X
2. Phương pháp bảo toàn liên kết ?
Ta xem số mol liên kết π được tính bằng = số mol phân tử \times số liên kết π
=> nπ = {{n}_{{{H}_{2}}}}phản ứng + {{n}_{B{{r}_{2}}}}phản ứng
VII. Điều chế và ứng dụng của alkene
1. Điều chế
a. Trong phòng thí nghiệm
- Tách nước khỏi rượu:
Tổng quát: CnH2n+1OH \xrightarrow{{{H_2}S{O_4}\,đặc,\,{{170}^o}C}} CnH2n + H2O
- Tách HX khỏi dẫn xuất halogen:
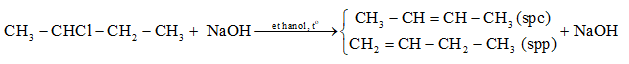
- Tách X2 từ dẫn xuất dihalogen:
CH2Br – CH2Br + Zn → CH2=CH2 + ZnBr2
a. Trong công nghiệp
- Các alkene được điều chế từ alkane bằng phản ứng tách hydrogen:
CnH2n+2 \xrightarrow{{{t^o},\,xt,\,p}} CnH2n + H2
- Ethylen:
+ Điều chế bằng cách nhiệt phân propane:
CH3 – CH2 – CH3 \xrightarrow{{{{\text{t}}^{\text{o}}}}} CH2 = CH2 + CH4
+ Cộng hợp H2 vào acetylene:
CH≡CH + H2 \xrightarrow{{{\text{Pd,}}{{\text{t}}^{\text{o}}}}} CH2=CH2
2. Ứng dụng
- Các alkene và dẫn xuất của alkene là nguyên liệu cho nhiều quá trình sản xuất hóa học.
- Ethylene, propilene, butylene dùng làm chất đầu để tổng hợp các polymer có nhiều ứng dụng.
- Khí ethylene được dùng để ủ giúp trái cây mau chín.


