I. Định nghĩa, phân loại alcohol
1. Định nghĩa
Alcohol là những hợp chất hữu cơ mà phân tử có nhóm –OH liên kết trực tiếp với nguyên tử C no.
2. Phân loại
- Theo cấu tạo gốc hiđrocacbon: alcohol no, alcohol không no, alcohol thơm (phân tử chứa vòng benzen).
- Theo số lượng nhóm OH: alcohol đơn chức, alcohol đa chức.
- Theo bậc alcohol (bằng bậc của C mang nhóm –OH).
a. Alcohol no, đơn chức, mạch hở
CnH2n+1OH (hoặc CnH2n+2O) (n ≥ 1)
b. Alcohol no, đa chức, mạch hở
CnH2n+2-m (OH)m (hoặc CnH2n+2Om ) (m >1, n ≥ m )
c. Alcohol không no chứa 1 liên kết đôi C=C, đơn chức, mạch hở
CnH2n-1 OH (hoặc CnH2nO) (n ≥ 3)
II. Đồng phân của alcohol
* Điều kiện bền của alcohol
- Nhóm -OH đính vào C no
- Chỉ có 1 nhóm -OH đính vào 1 C
Đồng phân
CTPT CnH2n+2O no, đơn chức mạch hở có đồng phân:
+ Mạch C (n ≥ 4).
+ Nhóm chức (chức alcohol và chức ether) ((n ≥ 2).
+ Vị trí nhóm chức (n ≥ 3).
Ví dụ: CTPT C3H8O có bao nhiêu đồng phân ?
+ Đồng phân alcohol: CH3-CH2-CH2OH và CH3-CH(OH)-CH3
+ Đồng phân ether: CH3-CH2-O-CH3
III. Danh pháp của alcohol
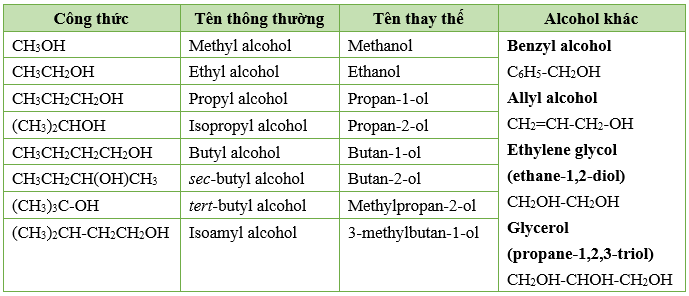
1. Tên thông thường (tên gốc chức)
Tên gốc hydrocarbon + alcohol
Ví dụ: CH3OH: methyl alcohol, C2H5OH: ethyl alcohol
2. Tên thay thế
Tên gốc hydrocarbon tương ứng + số chỉ vị trí nhóm –OH + ol
Chú ý:
+ Chọn mạch chính là mạch C dài nhất liên kết với nhóm –OH.
+ Đánh số thứ tự từ nguyên tử cacbon gần nhóm –OH hơn.
Ví dụ:
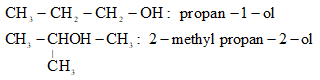
IV. Tính chất vật lý và liên kết hydrogen của alcohol
Alcohol có nhiệt độ nóng chảy, nhiệt độ sôi và độ tan trong nước cao hơn so với hydrocarbon, dẫn xuất halogen, ether có khối lượng phân tử tương tự.
Nguyên nhân: alcohol có liên kết –O–H phân cực nên hình thành được liên kết hydrogen với nhau (làm tăng nhiệt độ nóng chảy, nhiệt độ sôi) và với nước (làm tăng độ tan trong nước).
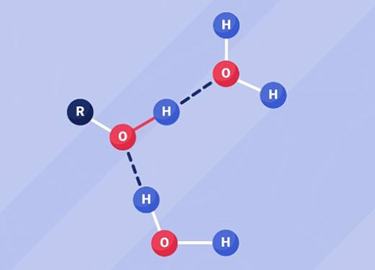
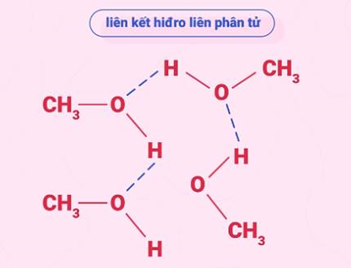
Liên kết hydrogen giữa alcohol với nước và liên kết hydrogen giữa các phân tử alcohol với nhau
V. Phương pháp giải bài tập phản ứng đốt cháy ancol
* Ancol no, mạch hở , a chức có công thức phân tử CnH2n+2Oa
CnH2n+2Oa+3n+1−a2O2to→nCO2+(n+1)H2O
=> Đốt cháy ancol no luôn cho: nH2O>nCO2và nancol= nH2O− nCO2
Phương pháp giải nhanh
+ Đốt cháy ancol no, đơn chức, mạch hở luôn thu được nO2nCO2=1,5
+ Số mol H2O > số mol CO2 => ancol đốt cháy là ancol no, mạch hở.
=> Số mol ancol no, mạch hở = Số mol H2O – số mol CO2
+ Áp dụng định luật bảo toàn nguyên tố oxi: a.nancol+ 2.nO2= nH2O+2.nCO2
Chú ý: Phản ứng đốt cháy của ancol có đặc điểm tương tự phản ứng đốt cháy hiđrocacbon tương ứng:
+ Nếu đốt cháy ancol cho nH2O > nCO2 thì ancol đem đốt cháy là ancol no mạch hở và nAncol = nH2O - nCO2
+ Nếu đốt cháy ancol cho nH2O > 1,5.nCO2 thì ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin):
CH3OH → CO2 + 2H2O
+ Nếu đốt cháy ancol cho nCO2 = nH2O thì ancol đó có dạng CnH2nOx
CnH2nOx → nCO2 + nH2O
VI. Điều chế alcohol
1. Phương pháp tổng hợp
a. Từ alkene + H2O xúc tác H+ (H2SO4 hoặc H3PO4)
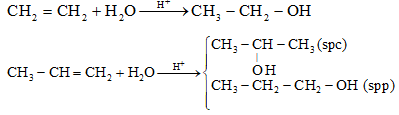
Cộng theo quy tắc Markovnikov: phần H cộng vào C mang nhiều H hơn, còn nhóm –OH cộng vào C mang ít H.
b. Thủy phân dẫn xuất halogen
C2H5Cl+NaOHto→C2H5OH+NaCl
c. Oxi hóa không hoàn toàn
2CH4+O2Cu/200oC,100atm→2CH3OH
CO+2H2ZnO, CrO3→400oC, 200atmCH3OH
Phương pháp này dùng để điều chế CH3OH trong công nghiệp.
d. Aldehyde (ketone) + H2
Aldehyde + H2 t0,Ni→ alcohol bậc 1
Ketone + H2 t0,Ni→ alcohol bậc 2
Ví dụ:
CH3CHO + H2 t0,Ni→ CH3CH2OH
CH3COCH3 + H2 t0,Ni→ CH3CH(OH)CH3
2. Phương pháp sinh hóa
Sản xuất ethyl alcohol từ tinh bột theo sơ đồ:
(C6H10O5)n+H2O→t0,xtC6H12O6 enzim→C2H5OH
(1) (C6H10O5)n+nH2Omen→nC6H12O6 (glucose)
(2) C6H12O6men rượu→2C2H5OH+2CO2
VII. Ứng dụng của alcohol
1. Ứng dụng của ethanol
- Làm nguyên liệu để sản xuất các hợp chất khác như diethyl ether, acetic acid, ethyl acetate,...
- Làm dung môi để pha chế vecni, dược phẩm, nước hoa,...
- Làm nhiên liệu.
2. Ứng dụng của methanol
Nguyên liệu để sản xuất formic aldehyde, methylamine, methyl chloride,...
Chú ý: Methanol là chất rất độc, chỉ cần một lượng nhỏ vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong.
VIII. Bài toán tính độ rượu
Độ rượu = VC2H5OHVddrượu (C2H5OH+H2O).100%
m = V . D
Trong đó:
V là thể tích dung dịch, thường dùng đơn vị là ml.
D là khối lượng riêng thường có đơn vị là g/ml.
mC2H5OH=VC2H5OH.DC2H5OH
mH2O=VH2O.DH2O=VH2O.1(DH2O≈1g/ml)
Khi cho hỗn hợp alcohol và nước phản ứng phản ứng với kim loại kiềm thì nước phản ứng với kim loại kiềm trước.

