I. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
1. Phản ứng một chiều
- Phản ứng chỉ ra theo một chiều từ trái sang phải được gọi là phản ứng một chiều.
- Chất phản ứng biến đổi hoàn toàn thành chất sản phẩm và không xảy ra theo chiều ngược lại.
Ví dụ: \[2KCl{O_3}\,\,\,\xrightarrow{{Mn{O_2},\,{t^o}}}\,\,\,2KCl\,\,\, + \,\,\,3{O_2}\]
Khi đun nóng các tinh thể KClO3 (xúc tác MnO2), KClO3 phân hủy thành KCl và O2. Cũng trong điều kiện đó, KCl và O2 không phản ứng được với nhau để tạo thành KClO3, nghĩa là phản ứng chỉ xảy ra một chiều từ trái sang phải.
2. Phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng trong cùng điều kiện thì phản ứng xảy ra theo hai chiều trái ngược nhau.
Ví dụ: $B{r_2}\,\, + \,\,\,{H_2}O\,\, \rightleftharpoons \,\,HBrO\,\, + \,\,HBr$
Br2 phản ứng với nước tạo thành dung dịch HBrO và HBr. HBrO là axit rất yếu (yếu hơn cả axit cacbonic) nhưng lại có tính oxi hóa, có thể oxi hóa HBr ngược lại thành Br2 và H2O.
3. Cân bằng hóa học
- Cân bằng hóa học: là trạng thái của phản ứng thuận nghịch khi tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
- Sự chuyển dịch cân bằng: là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
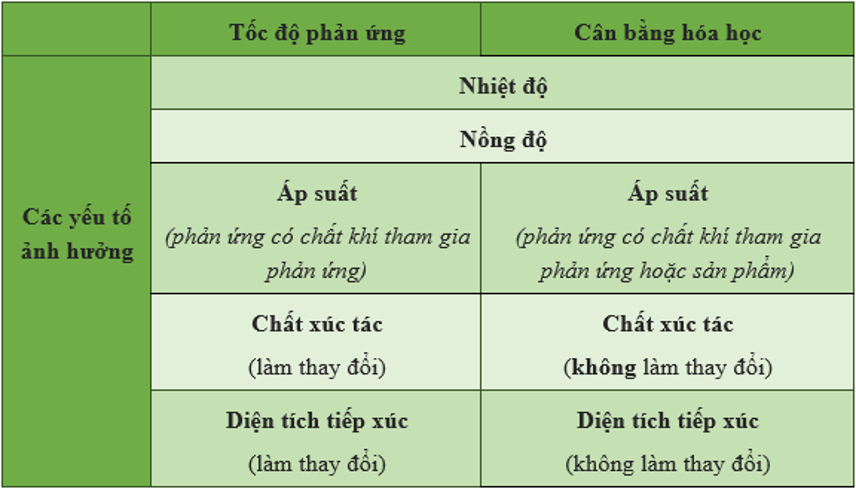
II. Các yếu tố ảnh hưởng đến cân bằng hoá học
1. Nguyên lý chuyển dịch Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
2. Giải thích các yếu tố ảnh hưởng đến cân bằng hoá học
- Khi hệ phản ứng thuận nghịch đang ở trạng thái cân bằng nếu ta thay đổi điều kiện nào đó thì cân bằng hoá học sẽ bị phá vỡ và hệ sẽ chuyển dịch đến một trạng thái cân bằng mới.
+ Nếu tăng nồng độ một chất thì cân bằng hóa học sẽ chuyển dịch theo chiều mà chất đó là chất tham gia phản ứng, còn nếu giảm nồng độ của một chất thì cân bằng hóa học sẽ chuyển dịch theo chiều sinh ra chất đó.
+ Khi tăng nhiệt độ thì cân bằng hoá học chuyển dịch theo chiều phản ứng thu nhiệt (có ΔH > 0). Còn khi giảm nhiệt độ thì cân bằng hóa học sẽ chuyển dịch theo chiều của phản ứng toả nhiệt (có ΔH < 0).
+ Khi tăng áp suất thì cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm số phân tử khí và ngược lại khi giảm áp suất thì cân bằng hóa học sẽ chuyển dịch theo chiều làm tăng số phân tử khí. Như vậy áp suất chỉ ảnh hưởng đến các phản ứng có số phân tử khí ở 2 vế của phương trình khác nhau.
+ Chất xúc tác không làm chuyển dịch cân bằng hóa học mà chỉ làm cho hệ nhanh đạt đến trạng thái cân bằng.
Ví dụ: Xét các yếu tố ảnh hưởng đến cân bằng sau:
2SO2 (k) + O2 (k) ⇆ 2SO3 (k) (∆H < 0)
Nồng độ:Nếu tăng nồng độ khí thì O2cân bằng chuyển dịch theo chiều giảm nồng độ khí O2.
$ \Rightarrow $ Cân bằng chuyển dịch theo chiều thuận.
Nhiệt độ:(∆H < 0: phản ứng tỏa nhiệt; ∆H > 0: phản ứng thu nhiệt).
- Nếu tăng nhiệt độ thì cân bằng chuyển dịch theo chiều giảm nhiệt độ.
Mà trong cân bằng trên chiều thuận là chiều tỏa nhiệt $ \Rightarrow $ cân bằng chuyển dịch theo chiều nghịch.
Áp suất:Nếu tăng áp suất thì cân bằng chuyển dịch theo chiều giảm áp suất (số mol nhỏ hơn).
Mà trong cân bằng trên tổng số mol khí chất phản ứng (1 + 2 = 3) lớn hơn số mol khí chất sản phẩm (bằng 2).
$ \Rightarrow $ Cân bằng chuyển dịch theo chiều thuận.
Lưu ý: nếu tổng số mol khí ở hai vế của cân bằng hóa học bằng nhau thì áp suất không làm chuyển dịch cân bằng.
Chất xúc tác: không làm chuyển dịch cân bằng.
III. So sánh tốc độ phản ứng và cân bằng hóa học