I. Lí thuyết chung về anđehit
I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Anđehit là những hợp chất hữu cơ mà phân tử có nhóm –CH=O liên kết trực tiếp với nguyên tử cacbon hoặc hiđro.
Thí dụ: H–CH=O ; CH3–CH=O ; C6H5–CH=O ; O=CH–CH=O
2. Phân loại
- Dựa vào cấu tạo gốc hiđrocacbon: anđehit no, anđêhit không no, anđehit thơm.
- Dựa vào số nhóm –CHO : anđehit đơn chức, anđehit đa chức.
a. Anđehit no, đơn chức, mạch hở: CnH2n+1CHO (n ≥ 0) hoặc CmH2mO (m ≥ 1).
b. Anđehit no, hai chức, mạch hở: CnH2n(CHO)2 (n ≥ 0) hoặc CmH2m-2O2 (m ≥ 2).
c. Anđehit không no chứa nối đôi C=C, đơn chức mạch hở: CmH2m-2O (m ≥ 3)
II. ĐỒNG PHÂN, DANH PHÁP
1. Đồng phân
Tương ứng với công thức CnH2nO dạng mạch hở có những loại đồng phân cấu tạo sau:
- Đồng phân mạch cacbon (n ≥ 4).
- Đồng phân nhóm chức:
+ Anđehit (-CHO), no, đơn chức mạch hở.
+ Xeton no, đơn chức, mạch hở.
+ Ancol đơn chức, không no chứa 1 liên kết đôi, mạch hở.
+ Ete đơn chức, không no chứa 1 liên kết đôi, mạch hở.
- Đồng phân vị trí nhóm chức.
2. Danh Pháp
a. Tên thay thế
Tên thay thế của anđehit no, đơn chức, mạch hở: Tên hiđrocacbon tương ứng với mạch chính + al
Ví dụ:
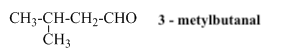
Chú ý: Mạch chính là mạch cacbon dài nhất bắt đâu từ nhóm –CHO
b. Tên thông thường
Anđehit + tên axit tương ứng
|
Công thức cấu tạo |
Tên thông thường |
Công thức cấu tạo |
Tên thông thường |
|
H–CH=O |
anđehit formic (formanđehit) |
(CH3)2CHCH2CHO |
Anđehit isovaleric |
|
CH3–CH=O |
anđehit axetic (axetanđehit) |
CH2=CH-CHO |
Anđehit acrylic |
|
CH3CH2CHO |
anđehit propionic (propionanđehit) |
CH2=C(CH3)-CHO |
Anđehit metacrylic |
|
CH3[CH2]2CHO |
anđehit butiric (butiranđehit) |
C6H5-CHO |
Anđehit benzoic (benzanđehit) |
|
CH3[CH2]3CHO |
anđehit valeric (valeranđehit) |
(CHO)2 |
Anđehit Oxalic |
III. TÍNH CHẤT VẬT LÝ
- Trạng thái: ở điều kiện thường HCHO, CH3CHO là chất khí, các anđehit còn lại tồn tại ở trạng thái lỏng hoặc rắn.
- Độ tan trong nước: HCHO, CH3CHO tan tốt, giảm dần khi M tăng.
- Anđehit có nhiệt độ sôi thấp hơn ancol có khối lượng phân tử tương đương nhưng cao hơn so với hiđrocacbon có cùng số nguyên tử C trong phân tử.
- Dung dịch nước của anđehit fomic được gọi là fomon. Dung dịch bão hòa của anđehit fomic (có nồng độ 37-40%) được gọi là fomlin.
II. Phương pháp giải bài tập oxi hóa hoàn toàn anđehit
Cũng giống như các hợp chất hữu cơ khác, anđehit dễ dàng tham gia vào phản ứng cháy khi được đốt nóng cùng oxi tạo ra sản phẩm cháy gồm CO2 và H2O:
CxHyOz + (x+y4−z2) O2 to→ xCO2 + y2 H2O
Một số chú ý khi giải bài tập về phản ứng đốt cháy anđehit:
- Đốt cháy anđehit bất kì không bao giờ thu được số mol H2O > số mol CO2.
- Nếu đốt cháy một anđehit mạch hở có k liên kết π trong phân tử thì nCO2 − nH2O =(k−1).nanehit
- Dựa vào mối quan hệ số mol giữa các sản phẩm cháy với số mol anđehit tham gia phản ứng có thể xác định được loại anđehit tham gia phản ứng.
Một số trường hợp thường gặp là:
+ Nếu nCO2 = nH2O => anđehit thuộc loại no, đơn chức, mạch hở:
+ Nếu nCO2 − nH2O = nanehit => anđehit thuộc loại no, 2 chức, mạch hở (CnH2n-2O2) hoặc anđehit không no, mạch hở, 1 liên kết đôi C=C (CnH2n-2O)
Ngoài ra, nhiều bài toán vẫn được giải một cách đơn giản dựa vào các định luật bảo toàn nguyên tố, bảo toàn khối lượng, công thức tính số nguyên tử C và H tương tự như với các chất hữu cơ khác.
III. Phương pháp giải các dạng bài tập phản ứng oxi hóa không hoàn toàn anđehit
I. TÁC DỤNG VỚI DUNG DỊCH AgNO3/NH3 (PHẢN ỨNG TRÁNG BẠC)
Phương trình phản ứng tổng quát:
RCHO + 2AgNO3 + 3NH3 + H2O to→ RCOONH4 + 2NH4NO3 + 2Ag
R(CHO)a + 2aAgNO3 + 3aNH3 + aH2O to→ R(COONH4)a + 2aNH4NO3 + 2aAg
- Phản ứng chứng minh anđehit có tính khử và dùng để nhận biết anđehit.
Nhận xét: ta thấy tỷ lệ nRCHO: nAg= 1:2
+ Riêng đối với anđehit fomic HCHO, phản ứng xảy ra qua 2 giai đoạn theo sơ đồ sau:
HCHO [ Ag(NH3)2 ] OH→ HCOONH4 + 2Ag
HCOONH4 [ Ag(NH3)2 ] OH→ (NH4)2CO3 + 2Ag
Vậy nếu dư AgNO3/NH3 thì tỉ lệ nHCHO: nAg= 1:4
+ Đối với anđehit R(CHO)n khi thực hiện phản ứng tráng gương ta có:
R(CHO)n [ Ag(NH3)2 ] OH→ 2n Ag
* Một số chú ý khi giải bài tập về phản ứng tráng bạc của anđehit:
- Phản ứng tổng quát ở trên áp dụng với anđehit không có nối ba nằm đầu mạch. Nếu có nối ba nằm ở đầu mạch thì H của C nối ba cũng bị thay thế bằng Ag.
- Các đặc điểm của phản ứng tráng bạc của anđehit:
+ Nếu nAg = 2.nanđehit thì anđehit thuộc loại đơn chức và không phải HCHO.
+ Nếu nAg = 4.nanđehit thì anđehit đó thuộc loại 2 chức hoặc HCHO.
+ Nếu nAg > 2.nhỗn hợp các anđehit đơn chức thì hỗn hợp đó có HCHO.
+ Số nhóm CHO = nAg2nanehit (nếu trong hỗn hợp không có HCHO).
- Đối với anđehit n chức 1 mol anđehit cho 2n mol Ag (n là số nhóm –CHO).
* Hợp chất vừa có chức anđehit vừa có liên kết ba đầu mạch -C≡CH
- Hợp chất vừa có chức anđehit vừa có liên kết ba đầu mạch C≡C- khi cho tác dụng với dd AgNO3/NH3 sẽ phản ứng ở cả 2 phần nhóm chức (anđehit và C≡C-)
Ví dụ: HC≡C-R-CHO + 3AgNO3 + 4NH3 + H2O → AgC≡C-R-COONH4 ↓ + 2Ag + 3NH4NO3
2. TÁC DỤNG VỚI DUNG DỊCH BROM
PTTQ: RCHO + Br2 + H2O → RCOOH + 2HBr
- Nếu anđehit còn liên kết π ở gốc hiđrocacbon thì xảy ra đồng thời phản ứng cộng Br2 vào liên kết π đó.
3. TÁC DỤNG VỚI Cu(OH)2/OH- , t0
PTTQ: RCHO + 2Cu(OH)2 + NaOH t0→ RCOONa + Cu2O↓đỏ gạch + 3H2O
=> phản ứng sinh ra kết tủa đỏ gạch, dùng để nhận biết anđehit
4. TÁC DỤNG VỚI DUNG DỊCH KMnO4
PTTQ: 3RCHO + 2KMnO4 + H2O → 3RCOOH + 2MnO2 + 2KOH
=> phản ứng làm mất màu dung dịch KMnO4, dùng để nhận biết anđehit.
*Chú ý: Đối với anđehit fomic HCHO coi như là anđehit 2 chức
HCHO + 2Br2 + H2O → CO2 + 4HBr
3HCHO + 4KMnO4 to→ 3CO2 + 4MnO2 + 4KOH + H2O
HCHO + 4AgNO3 + 6NH3 + 2H2O to→ (NH4)2CO3 + 4NH4NO3 + 4Ag
IV. Điều chế, ứng dụng của anđehit
I. PHƯƠNG PHÁP CHUNG
1. Oxi hóa nhẹ ancol bậc 1:
RCH2OH+CuOto→RCHO+Cu+H2O
2. Điều chế qua ancol không bền
- Cộng H2O vào C2H2:
C2H2 + H2O H2SO4, HgSO4, 80oC→ CH3CHO
- Thủy phân este của ancol không bền thích hợp:
CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO
- Thủy phân dẫn xuất 1,1-đihalogen:
RCHCl2+2NaOHto→RCHO+2NaCl+H2O
*Thủy phân dẫn xuất halogen không no:
R−CH=CHCl+NaOHto→RCH2CHO+NaCl
II. PHƯƠNG PHÁP RIÊNG
+ Fomanđehit được điều chế trong công nghiệp bằng cách oxi hóa metan hoặc metanol nhờ oxi không khí
CH4 + O2 xt,to→ HCHO + H2O
2CH3OH + O2 Ag,600oC→ 2HCHO + 2H2O
+ Oxi hóa etilen là phương pháp hiện đại để sản xuất axetanđehit
2CH2=CH2 + O2 PdCl2,CuCl2→ 2CH3CHO
III. ỨNG DỤNG
a) Fomanđehit được dùng để sản xuất poli (phenol-fomanđehit) (làm chất dẻo) và dùng trong tổng hợp phẩm nhuộm, dược phẩm.
- Dung dịch 37 – 40% fomanđehit trong nước được gọi là fomalin (hay fomon) được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng, …
b) Axetanđehit chủ yếu được dùng để sản xuất axit axetic

