Dòng điện trong chất điện phân là dòng chuyển động có hướng
Dòng điện trong chất điện phân là dòng chuyển dịch có hướng của các ion dương về catôt và ion âm về anot.
Khi nhiệt độ tăng điện trở của chất điện phân giảm là do ?
Khi nhiệt độ càng tăng thì chất điện li phân li càng tốt \( \Rightarrow \) tạo ra nhiều hạt tải điện.
\( \Rightarrow \) Khi nhiệt độ tăng, điện trở của chất điện phân giảm là do số ion dương và ion âm trong bình điện phân tăng.
Hiện tượng cực dương tan xảy ra khi điện phân dung dịch
Hiện tương dương cực tan xảy ra khi điện phân dung dịch muối kim loại có anốt làm bằng kim loại đó.
Cho dòng điện không đổi chạy qua bình điện phân thì khối lượng chất giải phóng ở điện cực
Khối lượng chất giải phóng ở điện cực: \(m = k.q = \frac{1}{F}.\frac{A}{n}.I.t\)
 Trong đó: \(k = \frac{1}{F}.\frac{A}{n};q = I.t\)
Trong đó: \(k = \frac{1}{F}.\frac{A}{n};q = I.t\)
A, B, C – sai
D – đúng vì điện lượng \(q = It\), khối lượng m tỉ lệ thuận với q.
Một bình điện phân chứa dung dịch đồng sunphat \(\left( {CuS{O_4}} \right)\) với hai điện cực bằng đồng (Cu) . Người ta cho dòng điện không đổi có cường độ 5A chạy qua bình điện phân này rồi ghi lại độ tăng khối lượng của catốt theo thời gian. Đồ thị biểu diễn sự phụ thuộc của khối lượng catốt tăng lên theo thời gian được biểu diễn như hình bên. Đương lượng điện hóa của đồng (Cu) xác định được từ số liệu ở đồ thị trên là
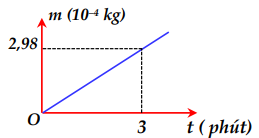
Khối lượng của chất giải phóng ở điện cực được tính bằng công thức:
\(m = \frac{1}{F}.\frac{A}{n}.It\)
Mà đương lượng điện hóa \(k = \frac{1}{F}.\frac{A}{n}\)
\(m = k.It \Rightarrow k = \frac{m}{{I.t}}\)
Từ đồ thị ta có: \(t = 3phut = 180s \Rightarrow m = 2,{98.10^{ - 4}}kg\)
\( \Rightarrow k = \frac{m}{{I.t}} = \frac{{2,{{98.10}^{ - 4}}}}{{5.180}} = 3,{31.10^{ - 7}}\left( {Kg/C} \right)\)
Có một bình điện phân chứa một dung dịch muối kim loại, điện cực bằng chính kim loại đó. Sau khi cho dòng điện khoảng \(\frac{1}{4}A\) chạy qua trong 1 giờ, ta thấy khối lượng ca tốt tăng \(1{\rm{ }}gam.\) Hỏi catôt làm bằng kim loại gì?
Khối lượng catot tăng lên là:
\(m = \dfrac{1}{F}.\dfrac{A}{n}.It \Rightarrow A = \dfrac{{mFn}}{{It}} = \dfrac{{1.96500.n}}{{\dfrac{1}{4}.3600}} \approx 108n\)
\( \Rightarrow \left\{ \begin{array}{l}n = 1\\A = 108\end{array} \right.\)
Vậy điện cực được làm bằng bạc.
Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là 25cm2, người ta dùng nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch CuSO4 rồi cho dòng điện có cường độ I = 10A chạy qua trong thời gian 1 giờ 20 phút. Biết ACu = 64, nCu = 2 và khối lượng riêng của đồng là ρCu = 8,9g/cm3. Bề dày của lớp mạ là
Cách giải:
Đổi: t = 1 giờ 20 phút = 4800s
Thể tích của lớp đồng bám trên mỗi mặt của tấm sắt là:
Áp dụng định luật Fa – ra – đây ta có: \(m = \frac{1}{{96500}}.\frac{A}{n}.It = \frac{1}{{96500}}.\frac{{64}}{2}.10.4800 \approx 15,92g\)
Thể tích của lớp đồng bám trên mỗi mặt của tấm sắt là: \(V = \frac{m}{{2\rho }} = \frac{{15,92}}{{2.8,9}} = 0,894c{m^3}\)
Bề dày của tấm mạ: \(d = \frac{V}{S} = \frac{{0,894}}{{25}} = 0,0358cm\)
Một bình điện phân chứa dung dịch đồng sunphat \(\left( {CuS{O_4}} \right)\) với hai điện cực bằng đồng (Cu) . Người ta cho dòng điện không đổi có cường độ 5A chạy qua bình điện phân này rồi ghi lại độ tăng khối lượng của catốt theo thời gian. Đồ thị biểu diễn sự phụ thuộc của khối lượng catốt tăng lên theo thời gian được biểu diễn như hình bên. Đương lượng điện hóa của đồng (Cu) xác định được từ số liệu ở đồ thị trên là
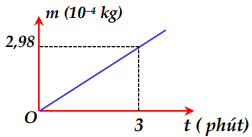
Khối lượng của chất giải phóng ở điện cực được tính bằng công thức:
\(m = \frac{1}{F}.\frac{A}{n}.It\)
Mà đương lượng điện hóa \(k = \frac{1}{F}.\frac{A}{n}\)
\(m = k.It \Rightarrow k = \frac{m}{{I.t}}\)
Từ đồ thị ta có: \(t = 3phut = 180s \Rightarrow m = 2,{98.10^{ - 4}}kg\)
\( \Rightarrow k = \frac{m}{{I.t}} = \frac{{2,{{98.10}^{ - 4}}}}{{5.180}} = 3,{31.10^{ - 7}}\left( {Kg/C} \right)\)
Một vật kim loại diện tích 120 cm2 được mạ niken. Dòng điện chạy qua bình điện phân có cường độ 0,30 A và thời gian mạ là 5 giờ. Xác định độ dày của lớp niken phủ đểu trên mặt vật kim loại. Niken (Ni) có khối lượng mol là A = 58,7 g/mol, hoá trị n = 2 và khối lượng riêng D = 8,8.103kg/m3, lấy số Fa-ra-đây F = 96500 C/mol. Độ dày của lớp niken phủ đều trên mặt vật kim loại là
Cách giải:
Công thức tính khối lượng: m = ρV = ρ.S.d
Mặt khác khối lượng niken được giải phóng ra ở catôt được tính theo công thức Fa-ra-đây :
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
Suy ra: \(\rho .S.d = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow d = \frac{{A.I.t}}{{96500.n.\rho S}} = \frac{{58,{{7.10}^{ - 3}}.0,3.5.3600}}{{96500.2.8,{{8.10}^3}{{.120.10}^{ - 4}}}} = 1,{56.10^{ - 5}}m = 15,6\mu m\)
Chọn đáp số đúng. Đương lượng điện hóa của niken là k = 3.10-4 g/C. Khi cho một điện lượng 10 C chạy qua bình điện phân có anot bằng niken thì khối lượng niken bám vào catot là:
Cách giải:
Đương lượng điện hóa của niken là k = 3.10-4 g/C
Điện lượng Q = 10C
Khối lượng niken bám vào catot là : m = k.Q = 3.10-4.10 = 3.10-3 g
Cho mạch điện gồm 2 nguồn ghép nối tiếp, E1 = 12V, r1 = 2Ω vàE2 = 6V, r2 = 0,5Ω; bộ nguồn mắc với điện trở R = 5,5Ω là bình điện phân dung dịch CuSO4 có dương cực bằng đồng, tạo thành mạch kín. Tính khối lượng hao mòn ở atốt sau 10 phút? (Cho ACu = 64g/mol ; nCu = 2).
Suất điện động và điện trở trong của bộ nguồn:
Eb = E1 + E2 = 12 + 6 = 18V
rb = r1 + r2 = 2 + 0,5 = 2,5Ω
Cường độ dòng điện: I = E/(Rn+ r) = 18/(5,5+2,5) = 2,25A
Vậy m = AIt/Fn = 64.2,25.600/(96500.2) = 0,45g
Điện phân cực dương tan một dung dịch trong 20 phút thì khối lượng cực âm tăng thêm 4 gam. Nếu điện phân trong một giờ với cùng cường độ dòng điện như trước thì khối lượng cực âm tăng thêm là
Công thức của định luật Fa-ra-đây tính khối lượng chất tạo thành ở điện cực là \(m = {1 \over F}.{A \over n}.It\)
Do đó ta có \({{{m_2}} \over {{m_1}}} = {{{t_2}} \over {{t_1}}} = 3 \Rightarrow {m_2} = 3{m_1} = 12g\)
Để bóc một lớp đồng dày có khối lượng 8,9.10-3g, bám trên bề mặt của một tấm kim loạingười ta dùng phương pháp điện phân dương cực tan. Cường độ dòng điện qua bình điện phân là 0,01 A. Cho A = 64 g/mol và n = 2. Thời gian cần thiết là
Ta có
\(m = \frac{1}{F}.\frac{A}{n}.I.t = > t = \frac{{m.F.n}}{{A.I}} = \frac{{8,{{9.10}^{ - 3}}.96500.2}}{{0,01.64}} = 2683,9s\)
Một bình điện phân dung dịch CuSO4 với điện cực làm bằng đồng có điện trở 5Ω. Bình điện phân được mắc vào nguồn điện có suất điện động 12V, điện trở trong 1Ω trong thời gian 16 phút 5 giây. Khối lượng đồng bám vào cực âm là:
Ta có cường độ dòng điện là: \(I = {E \over {r + R}} = {{12} \over {1 + 5}} = 2A\)
Áp dụng công thức định luật Faraday: \(m = {1 \over F}.{A \over n}.I.t = {1 \over {96500}}.{{64} \over 2}.2.(16.60 + 5) = 0,64g\)
Một bình điện phân đựng dung dịch CuSO4 với cực dương bằng đồng được nối vào hiệu điện thế một chiều U = 6V. Sau 16 phút 5 giây khối lượng của catôt tăng thêm 6,36mg. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, có hoá trị 2. Điện trở của bình điện phân là
Áp dụng công thức Farraday về điện phân ta có:
\(m = \frac{1}{F}.\frac{{A.I.t}}{n} \Rightarrow I = \frac{{m.n.F}}{{A.t}} = \frac{{6,{{36.10}^{ - 3}}.2.96500}}{{64.965}} = 0,019875A\)
Lại có:
\(I = \frac{U}{R} \Rightarrow R = \frac{U}{I} = \frac{6}{{0,019875}} = 301,9_{}^{}\Omega \)
Một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 20V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
Cách giải:
Ta có: t = 16 phút 5 giây = 965s
Khối lượng bạc bám vào anot được tính theo công thức:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow I = \frac{{96500.n.m}}{{A.t}} = \frac{{96500.4,32.1}}{{108.965}} = 4A\)
Điện trở của bình điện phân là: \(R = \frac{U}{I} = \frac{{20}}{4} = 5\Omega \)
Cho dòng điện có cường độ \(2\,\,\left( A \right)\) chạy qua bình điện phân đựng dung dịch muối đồng có cực dương bằng đồng trong \(1\) giờ \(4\) phút \(20\) giây. Khối lượng đồng bám vào cực âm là
Khối lượng đồng bám vào cực âm là:
\(m = \dfrac{1}{F}.\dfrac{{AIt}}{n} = \dfrac{1}{{96500}}.\dfrac{{64.2.\left( {1.3600 + 4.60 + 20} \right)}}{2} = 2,56\,\,\left( g \right)\)
Hạt mang tải điện trong chất điện phân là:
Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion dương theo chiều điện trường và các ion âm ngược chiều điện trường.
Bản chất dòng điện trong chất điện phân là
Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion dương theo chiều điện trường và các ion âm ngược chiều điện trường.
=> Bản chất dòng điện trong chất điện phân là dòng ion dương và dòng ion âm chuyển động có hướng theo hai chiều ngược nhau.
Trong các dung dịch điện phân , các ion mang điện tích âm là
Trong các dung dịch điện phân, các ion mang điện tích âm là gốc axít và gốc bazơ

