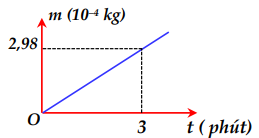
Một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 20V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
Trả lời bởi giáo viên
Cách giải:
Ta có: t = 16 phút 5 giây = 965s
Khối lượng bạc bám vào anot được tính theo công thức:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow I = \frac{{96500.n.m}}{{A.t}} = \frac{{96500.4,32.1}}{{108.965}} = 4A\)
Điện trở của bình điện phân là: \(R = \frac{U}{I} = \frac{{20}}{4} = 5\Omega \)
Hướng dẫn giải:
Phương pháp:
- Hệ thức định luật Ôm: \(I = \frac{U}{R}\)
- Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.