Đề bài
Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.
Cho 0,9 g chất A tác dụng với lượng dư dung dịch \(AgN{O_3}\) trong amoniac, thu được 5,4 g Ag.
Cho 0,2 mol A tác dụng với \({H_2}\) có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít \({H_2}\) (đktc).
Xác định công thức và tên chất A.
Phương pháp giải - Xem chi tiết
+) A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức, A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag => A chứa nhóm chức anđehit.
+) B có công thức R(CH2OH)x
+) Viết PTHH: R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O \( \to \) R(COONH4)2 + 4NH4NO3 + 4Ag\( \downarrow \)
+) Tính theo PTHH => Khối lượng mol của A => R.
Lời giải chi tiết
A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag ; vậy A có chức anđehit.
0,2 mol anđehit kết hợp với hiđro phải tạo ra 0,2 mol ancol B có công thức R(CH2OH)x
R(CH2OH)x + xNa \( \to \) R(CH2ONa)x + \(\dfrac{x}{2}\)H2
Theo phương trình 1 mol B tạo ra \(\dfrac{x}{2}\) mol H2
Theo đầu bài 0,2 mol B tạo ra 0,2 mol H2
\(\dfrac{1}{{0,2}} = \dfrac{x}{{0,4}} \Rightarrow x = 2\)
Vậy B là ancol hai chức và A là anđehit hai chức.
R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O \( \to \) R(COONH4)2 + 4NH4NO3 + 4Ag\( \downarrow \)
Số mol anđehit A = \(\dfrac{x}{4}\)số mol Ag = \(\dfrac{1}{4}.\dfrac{{5,4}}{{108}}\) = 0,0125 (mol)
Khối lượng 1 mol A = \(\dfrac{{0,9}}{{0,0125}}\) = 72(g).
R(CHO)2 = 72 \( \Rightarrow \) R = 72 - 2.29 = 14. Vậy R là \(C{H_2}\)
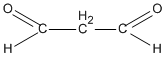 propanđial
propanđial

