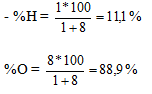Ngày soạn:
Bài 36. NƯỚC (T1)
I. MỤC TIÊU:
1. Kiến thức:
- Thành phần định tính và định lượng của nước
- Vai trò của nước trong đời sống và trong SX, sự ô nhiễm nguồn nước và cách bảo vệ nguồn nước.
- Vận dụng vào giải thích các hiện tượng trong thực tế.
2. Kĩ năng:
- Quan sát TN hoặc hình ảnh TN phân tích hoặc tổng hợp nước, rút ra được nhận xét về thành phần của nước.
3. Thái độ:Giúp HS có thái độ yêu thích hoc bộ môn hoá học.
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Chuẩn bị của GV:
- Hình 5.10 và 5.11 SGK/121 – 122.
- Bài tập vận dụng.
2. Chuẩn bị của HS:Tìm hiểu nội dung bài học trước khi lên lớp.
III. PHƯƠNG PHÁP: Quan sát, giải thích, TN biểu diễn, hoạt động nhóm, đàm thoại gợi mở..
IV. TIẾN TRÌNH BÀIDẠY
1. Kiểm tra bài cũ.
2 Bài mới: Giới thiệu bài: Có những nguyên tố hoá hoc nào trong thành phần của nước. Chúng hoá hợp với nhau theo tỉ lệ nào về thể tích và khối lượng. Để trả lời những câu hỏi này ta vào bài học hôm nay bài 36 “nước”.
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
|
Hoạt động 1.Sự phân huỷ nước. |
||
|
-GV: Treo tranh hình 5.10 SGK/121và giới thiệu cách phân huỷ nước bằng dòng điện. -GV:Cho HS nhận xét thể tích khí ở hai ống nghiệm. -GV: Đốt khí ở ống nghiệm A ( điện cực âm) sẽ có tiếng nổ nhẹ tạo ra nước. Đó là khí gì? -GV: Khí ở ống nghiệm B ( điện cực dương) làm que đóm bùng cháy. Đó là khí gì? -GV Vậy khi phân tích nước ta được khí gì? -GV: Cho biết tỉ lệ vê thể tích ở hai ống nghiệm? -GV:Yêu cầu HS viết phương trình phản ứng? |
-HS: Quan sát và nghe giảng. -HS: Thể tích ở ống nghiệm A gấp đôi ống nghiệm B. -HS: Nghe giảng và trả lời: Khí hiđro. -HS: Lắng nghe và trả lời: Khí oxi. -HS:Khí hidro và khí oxi. -HS: Khí hidro gần gấp đôi khí oxi. -HS: Viết PTHH xảy ra: 2H2O ->2H2+O2 |
I. Thành phần hoá học của nước 1. Sự phân huỷ nước a. Thí nghiệm b. Nhận xét - Khi cho dòng điện một chiều đi qua nước trên bề mặt 2 điện cực sẽ sinh ra khí hidro và khí oxi -Thể tích khí hidro bằng 2 lần khí oxi c. Phương trình hoá học 2H2O ->2H2 + O2 |
|
Hoạt động 2. Sự tổng hợp nước. |
||
|
-GV: Treo tranh vẽ 5.11 SGK/122 mô tả thí nghiệm bằng thiết bị tổng hợp. -GV: Giới thiệu phương pháp tổng hợp nước. -GV: Vậy thể tích khí hidro và oxi nạp vào ống là bao nhiêu ? khác nhau hay bằng nhau? -GV: Chất khí còn lại làm que đóm bùng cháy đó là khí gì? -GV: Tỉ lệ về thể tích khí hidro và oxi trong nước là bao nhiêu? -GV giới thiệu: Vậy 1 thể tích khí oxi đã hoá hợp với 2 thể tích khí hidro để tạo nước -GV: Cho HS viết phương trình hoá học. -GV:Có thể tính được thành phần khối lượng các nguyên tố hidro và oxi trong nước không? Nếu dùng 2. 22,4 l khí hidro (đktc) và 1 . 2,24 l khí oxi thì tỉ lệ khối lượng các nguyên tố hidro và oxi trong phòng thí nghiệm là bao nhiêu? -GV:Qua 2 thí nghiệm có thể rút ra kết luậ gì về tính chất của nước? |
-HS:Các nhóm quan sát tranh. -HS: Nghe giảng và theo dõi hình 5.11. Nêu hiện tượng sảy ra. -HS: Thể tíchbằng nhau. -HS: Khí còn lại là khí oxi. -HS:2 thể tích khí hidro và 1 thể tích oxi. -HS: Nghe giảng và ghi nhớ. 2H2 + O2 ->2H2O -HS: Là 1 gam hidro và 8 gam oxihay 2 gam hidro và 16 gam oxi. Công thức hoá học của nước là: H2O
-HS: Rút ra nhận xét và ghi vở. |
2. Sự tổng hợp nước a. Mô tả thí nghiệm b. Nhận xét Sau khi đốt bằng tia lửa điện hỗn hợp 4 thể tích khí hidro và oxi sẽ còn 1 thể tích khí oxi. Vậy 1 thể tích khí oxi đã hoá hợp với 2 thể tích khí hidro để tạo ra nước 2H2 + O2 ->2H2O 3. Kết luận - Nước là hợp chất tạo bởi 2 nguyên tố là hidro và oxi. - Hoá hợp với nhau theo tỉ lệ thể tích 2 phần khí hidro và 1 phần khí oxi. - Theo tỉ lệ khối lượng là 1 phần khí hidro và 8 phần khí oxi hay 2 phần khí hidro và 16 phần khí oxi suy ra ứng với 2 nguyên tử hidro và 1 nguyên tử oxi. - Vậy bằng thực nghiệm người ta tìm ra công thức hoá học của nước là H2O. |
3. Củng cố, luyện tập :
- HS nhắc lại nội dung chính của tiết học.
- GV yêu cầu HS làm bài tập 1, 3 SGK/125.
4. Hướng dẫn học sinh tự học ở nhà về nhà:
- Bài tập về nhà: 2 SGK/ 125.
- Chuẩn bị bài “ tiếp phần còn lại của bài 36”.
5. Phần bổ sung của đồng nghiệp hoặc cá nhân.
Ngày soạn:
BÀI 31: NƯỚC (T2)
I. MỤC TIÊU:
1. Kiến thức:
- Tính chất của nước: Nước hòa tan đươc nhiều chất, nước phản ứng được với nhiều chất ở đk thường như kim loại(Na,Ca...), oxit bazơ (CaO, Na2O...), oxit axit (P2O5,SO2...).
- Vai trò của nước trong đời sống và trong SX, sự ô nhiễm nguồn nước và cách bảo vệ nguồn nước.
2. Kĩ năng:
- Viết được PTHH của nước với 1 số kim loại(Na,Ca...) oxit bazơ , oxit axit .
- Biết sử dụng quỳ tím để nhận biết 1 số dd axit, bazơ cụ thể.
3. Thái độ: Có ý thức giữ cho nguồnnước không bị ô nhiễm.
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1.Chuẩn bị của GV:Nước tác dụng với kim loại , với oxit bazơ, với oxit axit.
2.Chuẩn bị của HS:Xem trước bài mới.
III. PHƯƠNG PHÁP: Quan sát, giải thích, TN biểu diễn, hoạt động nhóm, đàm thoại gợi mở.
IV. TIẾN TRÌNHBÀI DẠY
1. Kiểm tra bài cũ
Nêu thành phần hoá học của nước
Sửa bài tập 3/125
2. Bài mới:Giới thiệu bài: Em hãy kể vai trò của nước trong đời sống? Qua các phương tiện thông tin đại chúng chúng ta cũng biết tình trạng nước hiện nay như thế nào? Nguyên nhân từ đâu? Nước có những tính chất gì?
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
|
Hoạt động 1: Tính chất vật lí |
||
|
- GV: Cho HS quan sát mẫu nước - GV: Nêu tính chấtvật lí của nước ? |
- HS: Quan sát - HS: Nướclà chất lỏng không màu, không mùi, không vị, sôi ở 1000C. Hoà tan được nhiều chất rắn, lỏng, khí |
II. Tính chất của nước 1.Tính chất vật lí - Lỏng không màu, không mùi, không vị, sôi ở 1000C. - Hoà tan được nhiều chất. |
|
Hoạt động 2: Tính chất hoá học |
||
|
- GV:Yêu cầu HS quan sát thí nghiệm: cho Na vào cốc nước -> Nhúng một mẫu giấy quỳ tím vào dung dịch sau phản ứng. - GV: Tại sao phải dùng một lượng nhỏ Na thôi? - GV giới thiệu: Hợp chất tạo thành trong nước làm quỳ tím hoá xanh đó chính là bazơ - GV: Yêu cầu HS viết PTHH. - GV: Gọi HS đọc SGK/ 123. - GV: Cho một cục vôi nhỏ vào cốc thủy tinhrồi rót một ít nước vào vôi sống và yêu cầu HS quan sát? Khi nhúng giấy quỳ tím vào có hiện tượng gì? -GV: Vậy hợp chất được tạo thành là chất gì? - GV: Yêu cầu HS viết PTHH? - Thông báo: Ngoài ra nước còn hoá hợp với Na2O, K2O… tạo ra NaOH, KOH.. - GV: Gọi HS đọc SGK/123. - GV: Làm thí nghiệm đốt phốt pho đỏ trong oxi tạo thành P2O5 rồi rót 1 ít nước vào lọ đậy nút lại và lắc đều và nhúng một mẫu giấy quỳ vào dung dịch. - GV: Thông báo: Dung dịch làm quỳ tím hóa đỏ là dung dịch axit. Vậy hợp chất tạo ra ở phản ứng trên thuộc loại axit - GV: YC Viết PTHH - Thông báo: Nước còn hóa hợp với nhiều oxit axit khác như SO2, SO3, N2O5… - GV: Gọi HS đọc kết luận SGK |
- HS: Na chạy nhanh trên mặt nước nóng chảy thành giọt tròn.Giấy quỳ tím chuyển sang màu xanh - HS: Vì Phản ứng toả nhiều nhiệt có khí H2 thoát ra - HS: Nghe giảng - HS:2Na +2H2->2NaOH + H2 - HS: Đọc SGK - HS: Có hơi nước bốc lên CaO chuyển thành chất nhão, phản ứng toả nhiều nhiệt . Quỳ tím hoá xanh - HS: Hợp chất tạo thành là:Ca(OH)2. - HS: Viết PTHH - HS: Nghe giảng -HS: Đọc SGK - HS:Giấy quỳ tím hóa đỏ - HS: Nghe giảng - HS: 3H2O+P2O5 ->2H3PO4 - HS: Nghe giảng - HS:Đọc SGK |
2. Tính chất hoá học a.Tác dụng với kim loại 2Na + 2H2O -> 2NaOH + H2 - Nước có thể tác dụng với một số kim loại ở nhiệt độ thường K, Na, Ba, Ca b. Tác dụng với oxit bazơ H2O+CaO ->Ca(OH)2 - Hợp chất tạo ra do oxit bazơ hoá hợp với nước thuộc loại bazơ. Dung dịch bazơ làm quỳ tím chuyển sang màu xanh b. Tác dụng với oxit axit H2O+P2O5 ->H3PO4 - Hợp chất tạo ra do nước hóa hợp với oxit axit thuộc loại axit. Dung dịch axit làm đổi màu quỳ tím thành đỏ |
|
Hoạt động 3: Vai trò của nước trong đời sống và sản xuất – chống ô nhiễm nguồn nước |
||
|
- GV: Yêu cầu các nhóm thảo luận câu hỏi sau - Vai trò của nước trong đời sống và sản xuất ? - Chúng ta cầnlàm gì để giữ cho nguồn nước không bị ô nhiễm? - GV: Nhận xét. |
- HS: Các nhóm thảo luận nhóm và báo cáo kết quả. - HS: Lắng nghe |
III. Vai trò của nước trong đời sống và sản xuất- chống ô nhiễm nguồn nước (SGK) |
3. Cũng cố, luyện tập : Cho HS nhắc lại tính chất hoá học của nước và viết PTHH.
4. Hướng dẫn học sinh tự học ở nhà về nhà :
- Dặn các em làm bài tập về nhà: 1,5/ 125
- Chuẩn bị bài “ axit – bazơ - muối”.
- Ôn lại khái niệm, cách gọi tên, phân loại oxit.
5. Phần bổ sung của đồng nghiệp hoặc cá nhân.