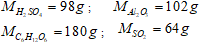Bài 18. MOL
I. MỤC TIÊU:
1. Kiến thức: Biết được:
- Định nghĩa : mol , khối lượng mol , thể tích mol của chất khí ở đktc: 00C, 1atm .
- Vận dụngđể tính được khối lượng của các chất , thể tích khí ở ( đktc)
2. Kĩ năng: Tính khối lượng mol nguyên tử, mol phân tử các chất trong công thức
3. Thái độ: Rèn cho HS tính cẩn thận khi tính toán.
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Chuẩn bị của GV: Hình 3.1 SGK/62.
2. Chuẩn bị của HS:Đọc trước bài ở nhà.
III. PHƯƠNG PHÁP: Hoạt động nhóm, vấn đáp, làm bài tập..
IV. TIẾN TRÌNH DẠYHỌC
1. Kiểm tra bài cũ: Sửa bài KT 1 tiết
2. Bài mới:
Giới thiệu bài: Nguyên tử , phân tử có kích thước , khối lượng cực kì nhỏ bé. Làm thế nào để biết được khối lượng và thể tích các chất trước và sau phản ứng? Để thực hiện được mục đích này , các nhà khoa học đã đề xuất một khái niệm dành cho các hạt vi mô , đó là mol (được đọc là mon ).
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
|
Hoạt động 1: Mol là gì? |
||
|
- GV nêu : “Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó” - GV giải thích con số 6.1023 được gọi là số Avogađro (kí hiệu là N). - GV cho HS đọc phần “em có biết ” để HS hình dung được con số 6.1023 to lớn nhường nào. -GV hỏi: + 1 mol nguyên tử sắt có chứa bao nhiêu nguyên tử sắt ? + 1 mol phân tử nước có chứa bao nhiêu phân tử nước ? +Vậy 0,5 mol phân tử nhôm có chứa bao nhiêu nguyên tử nhôm? +Vậy 2 mol nước có chứa bao nhiêu phân tử nước ? |
- HS: Ghi bài . - HS: Theo dõi và ghi vở. - HS: Đọc phần em chưa biết. -HS: +Chứa 6.1023 nguyên tử sắt ( N nguyên tử sắt ). +Chứa 6.1023 phân tử nước (N phân tử nước ). +Chứa: 0,5 . 6.1023 = 3.1023 nguyên tử nhôm. +Chứa : 2.6.1023 = 12.1023 |
I. MOL LÀ GÌ ? Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó. Ký hiệu N= 6.1023 : là số Avogađro VÍ dụ : - 1 mol nguyên tử sắt có chứa 6.1023 nguyên tử sắt ( N nguyên tử sắt ) - 1 mol phân tử nước có chứa 6.1023 phân tử nước (N phân tử nước ) |
|
Hoạt động 2. Khối lượng mol là gì? |
||
|
- GV giới thiệu : Khối lượng mol ( M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử của chất đó . -GV: Em hãy tính nguyên tử khối của C, Hphân tử khối của O2 , CO2 , H2O và suy ra khối lượng mol tương ứng. -GV: Tính khối lượng mol của các chất sau H2SO4 , AL2O3, C6H12O6 , SO2 . |
-HS:Nghe giảng và ghi vở. -HS: Thảo luận nhóm trong 5’, tính toán và suy ra khối lượng mol. -HS: Làm bài tập theo yêu cầu của GV: |
II. KHỐI LƯỢNG MOL LÀ GÌ ?Khối lượng mo ( kí hiệu là M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử của chất đó . Ví dụ : MC = 12g MO = 16g
|
Hoạt động 3. Thể tích mol của chất khí là gì? |
||
|
- GV: Cho 1 HS đọc thể tích mol của chất khí là gì ? - GV: Yêu cầu HS quan sát hình 3.1 SGK/64. -GV: Tính khốilượng mol cuả N2 , H2 , CO2 ? -GV: Yêu cầu HS nhận xét thể tích mol ( theo hình vẽ )của 3 phân tử chất trên ? - GV: Nêu một số lưu ý cần thiết khi làm bài tập. -GV: Yêu cầu HS rút ra kết luận chung. |
-HS: Thể tích mol của chất khílà thể tích chiếm bởi N phân tử của chất khí đó. -HS: Quan sát hình và nhận xét. - HS tính : MH2 = 2g MN2 = 28g MCO 2 = 44g -HS trả lời: Bằng nhau. -HS: Nghe và ghi nhớ. -HS: Nêu kết luận và ghi vở. |
III. THỂ TÍCH MOL CỦA CHẤT KHÍ : - Thể tích mol của chất khílà thể tích chiếm bơi N phân tử của chất khí đó. - Ở đktc(00c và1atm) , thể tích mol chất khí đều bằng22,4 l. |
3. Củng cố, luyện tập :
- HS nhắc lại nội dung chính của bài học.
- GV hướng dẫn HS làm các bài tập 1, 2 SGk/65.
4. Hướng dẫn học sinh tự học ở nhà :
- Làm bài tập 3, 4 SGk/ 65.
- Chuẩn bị bài: “Chuyển đổi giữa khối lượng, lượng chất và thể tích”.
5. Phần bổ sung của đồng nghiệp hoặc cá nhân