Ngày dạy:
Bài 32. PHẢN ỨNG OXI HOÁ - KHỬ
I. MỤC TIÊU:
1. Kiến thức: Biết được.
- KN vế chất khử, chất oxi hoá, sự khử, sự oxi hoá dựa trên cơ sở sự nhường oxi và sự nhận oxi.
- Vận dụng vào việc giải thích các hiện tượng trong thực tế.
2. Kĩ năng:
- Phân biệt được chất khử,chất oxi hoá, sự khử, sự oxi hoá trong các PTHH cụ thể.
- Phân biệt được phản ứng oxi hoá - khử với các phản ứng đã học.
- Tính được lượng chất khử, chất oxi hoá hoặc sản phẩm theo PTHH.
3. Thái độ: Vận dụng những kiến thức về oxi để áp dụng trong cuộc sống.
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Chuẩn bị của GV: Bảng phụ có bài tập về các loại phản ứng.
2. Chuẩn bị của HS: Xem trước bài ở nhà.
III. PHƯƠNG PHÁP: Quan sát, hoạt động nhóm, đàm thoại gợi mở, tư duy logic..
IV. TIẾN TRÌNH BÀIDẠY
1. Ổn định lớp:
1. Kiểm tra bài cũ :
HS1: Nêu các tính chất hoá học của hidro? Viết các phương trình phản ứng minh hoạ? Tại sao hỗn hợp khí hidro và oxi là hỗn hợp nỗ?
HS2: Làm bài tập 5 SGK/ 109.
3. Bàimới: Giới thiệu bài: Trong thực tế chúng ta thấy sắt bị gỉ, hiđro khử CuO, đó là những phản ứng oxi hoá – khử.Vậy thì phản ứng c thuộc loại phản ứng nào?
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
|
Hoạt động 1. Sự khử và sự oxi hoá |
||
|
-GV: Yêu cầu HS theo dõi PTHH H2 + CuO và nêu nhận xét về thành phần của các chất tham gia và sản phẩm. -GV:CuO đã bị tách O ra khỏi hợp chất của nó tạo ra Cu. Quá trình này gọi là sự khử. -GV: Vậy sự khử là gì? -GV:Yêu cầu HS nhắc lại sự oxi hoá là gì? -GV:Vậy phản ứng trên có xảy ra sự oxi hoá hay không? Vì sao? -GV: Hãy xác định sự khử và sự oxi hoá trong các phản ứng sau: H2 + Fe2O3 ->Fe + H2O H2 + O2 ->H2O |
-HS: H2 chiếm O của CuO để tạo thành H2O. - Nghe giảng -HS: Nghe giảng và ghi nhớ. -HS: Trả lời và ghi vở. -HS: Sự tác dụng của oxi với một chất goiï là sự oxi hoá. -HS: Có. Vì H đã kết hợp với O để tạo ra nước. -HS: Làm bài tập vào vở trong vòng 3 phút. Sau đó lên bảng làm bài tập |
I.Sự khử và sự oxi hoá 1. Sự khử - Sự tách oxi ra khỏi hợp chất gọi là sự khử 2. Sự oxi hoá - Sự tác dụng của oxi với một chất goiï là sự oxi hoá |
|
Hoạt động 2. Chất khử và chất oxi hoá |
||
|
-GV: Giới thiệu 2 ví dụ: CuO + H2Cu + H2O C + O2CO2 -GV: Giới thiệu: H2, C là những chất khử.Vậy thế nào là chất khử? Chất nào chất oxi hóa? -GV: CuO, O2 là chất oxi hoá. Vậy, chất oxi hoá là gì |
-HS: Quan sát ví dụ và trả lời câu hỏi:Chất chiếm oxi của chất khác là chất khử -HS: Chất nhường oxi cho chất khác là chất oxi hoá. |
II.Chấtkhử và chất oxi hoá - Chất chiếm oxi của chất kháclà chất khử - Chất nhường oxi cho chất khác là chất oxi hoá. |
Hoạt động 3.Phản ứngoxi hoá – khử |
||
|
-GV: Treo sơ đồ phản ứng CuO + H2. Yêu cầu HS nêu nhận xét về sự có mặt của sự khử, sự oxi hoá. -GV: Tất cả các phản ứng đó ta gọi là phản ứng oxi hoá khử. Vậy phản ứng oxi hoá khử là gì? |
-HS: Cả sự khử và oxi hoá đều có mặt trong 1 phản ứng. -HS: Trả lời và ghi vở. |
III. Phản ứng oxi hoá khử Phản ứng oxi hoá khử là phản ứng hoá học trong đó xảy ra đồng thời sự oxi hoá và sự khử 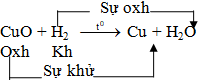
|
|
Hoạt động 4 . Tầm quan trọng của phản ứng oxi hoá-khử |
||
|
- GV: Gọi HS đọc phần 4 SGK và cho biết phản ứng oxi hoá khử có tầm quan trọng như thế nào ? |
- HS: Đọc SGK và trả lời câu hỏi. |
|
3. Củng cố, luyện tậpHãy lập PTHH theo các sơ đồ sau:
Fe2O3+ CO ->CO2+ Fe
Fe3O4+ H2 ->H2O + Fe
CO2+ Mg ->MgO + C
Các phản ứng hó học này có phải là phản ứng oxi hoá – khử không ? Vì sao? Nếu là phản ứng oxi hoá – khử , cho biết chất nào là chất khử, chất oxi hoá? Vì sao ?
4. Hướng dẫn học sinh tự học ở nhà :
- Làm bài tập 1 ,2, 3 ,4 ,5 trang113 SGK
- Dặn các em xem bài “ Điều chế hidro và phản ứng thế” .
5. Phần bổ sung của đồng nghiệp hoặc cá nhân.
Ngày soạn:
Bài 33. ĐIỀU CHẾ HIDRO – PHẢN ỨNG THẾ
I. MỤC TIÊU:
1. Kiến thức:
- Phương pháp điều chế khí hidro trong phòng thí nghiệm và trong công nghiệp, cách thu khí hiđro bằng cách đẩy nước và đẩy KK
- Phản ứng thế là phản ứng trong đónguyên tử đon chất thay thế nguyên tử của nguyên tố trong hợp chất.
2. Kĩ năng:
- Quan sát TN, hình ảnh....rút ra PP về đc và cách thu khí hiđro. hoạt động của bình kíp đơn giản
- Viết được PTHH ĐC khí hi đro từ kim loại: Zn, Fe và dd axit: HCl, H2SO4 loãng
- Phân biệt phản ứng thế với phản ứng oxi hoá- khử. Nhận biết phản ứng thế trong các PTHH cụ thể
- Tính được thể tích khí hi đro ĐC được ở đktc.
3. Thái độ: Giúp HS có thái độ yêu thích hoc bộ môn hoá học.
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1.GV: Chuẩn bị thí nghiệm điều chế khí hidro.
2.HS: Tìm hiểu nội dung bài học trước khi lên lớp.
III. PHƯƠNG PHÁP: Quan sát, giải thích, TN biểu diễn, hoạt động nhóm, đàm thoại gợi mở..
IV. TIẾN TRÌNH BÀIDẠY
1. Kiểm tra bài cũ :
2. Bài mới:Giới thiệu bài: Trong phòng thí nghiệm và trong công nghiệp khi người ta cần dùng khí hidro thì làm thế nào để điều chế được khí hidro. Phản ứng điều chế khí hidro trong phòng thí nghiệm thuộc loại phản ứng nào?
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
|
Hoạt động 1. Tìm hiểu cách điều chế hidro trong phòng thí nghiệm |
||
|
-GV: Làm thí nghiệm điều chế khí H2. Yêu cầu quan sát và nêu hiện tượng sảy ra. -GV: Đậy nút cao su. Đưatàn đóm vào đầu ống dẫn khí . Gọi HS nhận xét. -GV: Nhỏ một giọt dung dịch vào ống nghiệm rồi đem cô cạn sẽ thu được muối. Đó là muối gì? Yêu cầu HS viết phương trình phản ứng xảy ra? -GV hỏi: Có thể thu H2 bằng cách nào? -GV: Để điều chế hidro người ta còn thay Zn bằng Fe, Al, thay HCl bằng H2SO4. |
-HS: Quan sát và nêu hiện tượng: Có bọt khí xuất hiện. -HS: Khí thoát ra không làm cho than bùng cháy. -HS: Muối đó là ZnCl2: Zn + 2HCl ->ZnCl2 + H2 -HS: Đẩy nước và đẩy không khí.( Giống thu O2). -HS: Nghe giảng và ghi nhớ. |
I. Điều chế khí hidro trong phòng thí nghiệm 1. Trong phòng thí nghiệm Zn + 2HCl ->ZnCl2 + H2 |
|
Hoạt động 2.Tìm hiểu cách điềuchế hidro trong công nghiệp. |
||
|
-GV: Giới thiệu cách điều chế khí H2 trong công nghiệp: Điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc từ khí tự nhiên, khí dầu mỏ. -GV: Giới thiệu sơ đồ điện phân nước. |
-HS: Nghe giảngvà ghi vở. -HS: Nghe giảng và viết PT điện phân: 2H2O ->2H2+ O2 |
II. Điều chế khí hidro trong công nghiệp - Điện phân nước 2H2O ->2H2+ O2 - Dùng than khử oxi của nứơc - Điều chế hidro từ khí tự nhiên, khí dầu mỏ |
|
Hoạt động 3.Tìm hiểu phản ứng thế . |
||
|
-GV: Em đã được học các loại phản ứng nào? -GV: Trong phản ứng: Zn + 2HClZnCl2 +H2 Đâu là đơn chất? Đâu là hợp chất? -GV: Yêu cầu HS nhận xét đặc điểm của các chất trong phản ứng. -GV: Các phản ứng hoá học như trên gọi là phản ứng thế. Vậy phản ứng thế là gì? |
-HS: Phản ứng phân huỷ, phản ứng hoá hợp. -HS: Theo dõi và tìm hiểu: Zn là đơn chất HCl là hợp chất -HS: Nguyên tử của đơn chất Znđã thay thế nguyên tử H trong hợp chất HCl. -HS: Trả lời và ghi vở. |
III. Phản ứng thế - Phản ứng thế là phản ứng hoá học xảy ra giữa đơn chất và hợp chất. Trong đó nguyên tử của đơn chất thay thế cho nguyên tử của mộtnguyên tố trong hợp chất Ví dụ: Zn + 2HCl ->ZnCl2 + H2 |
3. Củng cố, luyện tập
- HS: Đọc phần đọc thêm để biết thêm về bình Kip điều chế H2.
- GV: Hướng dẫn HS làm bài tập 2, 5 SGK/117.
4. Hướng dẫn học sinh tự học ở nhà về nhà:
- Bài tập về nhà: 1,3,4 SGK/ 117.
- Chuẩn bị bài: “ Bài luyện tập 6 ”.
5. Phần bổ sung của đồng nghiệp hoặc cá nhân.

