Bài tập về sự điện phân
Kỳ thi ĐGNL ĐHQG Hồ Chí Minh
Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
nFe3+ = 0,2 mol ; nCu2+ = 0,05mol ; nFe2+ =0,05mol
mtăng = mCu + mFe => mFe = 8,8 – 0,05.64 = 5,6g => nFe = 0,1mol
Các ion đã điện phân ở catot: Fe3+ , Cu2+, Fe2+ điện phân 1 phần
netđ = nFe3+ + 2nCu2+ + 2nFe2+ = 0,2 + 0,05.2 + 0,1.2 = 0,5 mol
=> $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,5}{10}=4825s$
Điện phân l00 ml dung dịch CuSO4 0,2M với cường độ dòng điện I = 9,65A. Khối lượng Cu bám trên catot khi thời gian điện phân t1 = 200s và t2 = 500s (hiệu suất điện phân là 100%) lần lượt là
nCuSO4 = 0,02 mol => ne Cu2+ nhận tối đa = 0,02.2 = 0,04 mol
Khi t1 = 200s => ne trao đổi = I.t / F = 0,02 mol
=> nCu tạo ra = ne trao đổi / 2 = 0,01 mol => mCu (1) = 0,64 gam
Khi t2 = 500s => ne trao đổi = I.t / F = 0,05 > 0,04
=> nCu = nCuSO4 = 0,02 mol => mCu (2) = 1,28 gam
Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 > 0,02
→ Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hết
nAgNO3 = 0,08mol
Ag+ + 1e → Ag
0,08 → 0,08
Cu2+ + 2e → Cu
0,04 0,02
=> netđ= 0,04 + 0,08 = 0,12 mol
=> $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,12}{10}=1158s$
Điện phân một lượng dư dung dịch KCl với điện cực trơ, màng ngăn xốp thời gian 16,1 phút dòng điện I = 5A thu được 500 ml dung dịch X. pH của dung dịch X có giá trị là
ne trao đổi = I.t / F = 0,05 mol
Ở cực (-) điện phân H2O: 2H2O + 2e → H2 + 2OH-
=> nOH- = ne = 0,05 mol => [OH-] = 0,05 / 0,5 = 0,1 M
=> pOH = 1 => pH = 13
Điện phân dung dịch X chứa 0,4 mol M(NO3)2 (với điện cực trơ) trong thời gian 48 phút 15 giây, thu được 11,52 gam kim loại M tại catot và 2,016 lít khí (đktc) tại anot. Kim loại M và cường độ dòng điện là
Catot: M2+ + 2e → M
Anot: 2H2O → O2 ↑ + 4H+ + 4e
0,18 → 0,09 → 0,36
=> ne trao đổi = 4.nO2 = 0,36 mol
Mà ne = I.t / F => I = ne.F / t = 12A
nM = ne trao đổi / 2 = 0,18 mol => M = 11,52 / 0,18 = 64
=> M là Cu
Điện phân 500 ml dung dịch AgNO3 với điện cực trơ cho đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 800 ml dung dịch NaOH 1M. Biết I = 20 A, nồng độ mol AgNƠ3 và thời gian điện phân lần lượt là
Đến khi catot bắt đầu có khí thoát ra => Ag+ bị điện phân vừa hết
nNaOH = 0,8 mol => nH+ = 0,8 mol
Catot: Ag+ + 1e → Ag
Anot: 2H2O → O2 ↑ + 4H+ + 4e
=> ne trao đổi = nH+ = 0,8 mol
=> nAg+ = 0,8 mol => CM AgNO3 = 0,8 / 0,5 = 1,6M
n = I.t / F => t = n.F / I = 3860s
Điện phân dung dịch CuSO4 với điện cực trơ, cường độ dòng điện 10A. Khi ở anot có 4 gam khí oxi bay ra thì ngưng. Phát biểu nào sau đây là đúng ?
nO2 = 0,125 mol
Catot: Cu2+ + 2e → Cu
Anot: 2H2O → O2 ↑ + 4H+ + 4e
=> ne trao đổi = 4.nO2 = 0,5 mol
=> nCu = 0,5 / 2 = 0,25 mol => m = 16 gam => A đúng
t = n.F / I = 4825s => B sai
+) pH của dung dịch ban đầu giảm, khi hết Cu2+ thì nước điện phân ở catot tạo OH-, ở anot tạo ra H+ và nOH- = nH+ nên pH không đổi
+) hết Cu2+, nước điện phân ở catot tạo khí H2
Dung dịch X chứa HCl, CuSO4, Fe2(SO4)3. Lấy 400 ml dung dịch X đem điện phân với điện cực trơ, I = 7,72A đến khi ở catot thu được 5,12 gam Cu thì dừng lại. Khi đó chỉ thu được 0,1 mol một chất khí duy nhất thoát ra ở anot. Thời gian điện phân và nồng độ [Fe2+] sau điện phân lần lượt là
nCu = 0,08 (mol)
Catot:
Fe3+ + 1e → Fe2+
x x
Cu2+ + 2e → Cu
0,08 0,16 0,08
Anot: chỉ thu được 1 khí nên phải là Cl2
2Cl- - 2e → Cl2
0,2 0,1
Theo định luật bảo toàn e, ta có:
x + 0,16 = 0,2 => x = 0,04 (mol)
=> [Fe2+] = 0,04/0,4 = 0,1 (M)
$n_{e}=\frac{It}{F}\Rightarrow t=\frac{n_{e}F}{I}=\frac{0,2.96500}{7,72}=2500(s)$
Điện phân dung dịch chứa hỗn hợp hai muối CuCl2 và Cu(NO3)2 một thời gian, ở anot của bình điện phân thoát ra 448 ml hồn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot (biết trên catot không có khí thoát ra). Giá trị của m là:
n khí = 0,02 (mol)
Do có hỗn hợp khí nên ở Anot Cl- đã điện phân hết và đến H2O điện phân
Hỗn hợp khí là : Cl2 và O2 có số mol lần lượt là x, y.
$ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ \frac{{71{\text{x}} + 32y}}{{2(x + y)}} = 25,75 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ 71{\text{x}} + 32y = 1,03 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x = 0,01 \hfill \\ y = 0,01 \hfill \\ \end{gathered} \right.$
2Cl- - 2e → Cl2
0,02 0,01
2H2O - 4e → O2 + 4H+
0,04 0,01
=> ne = 0,06 (mol)
ở Catot chưa có khí thoát ra tức là Cu2+ dư
=> mCu = 0,03.64 = 1,92 (gam)
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Hai khí thoát ra ở anot là Cl2 và O2:
Ta có hệ phương trình:
\(\left\{ \begin{gathered}
\sum {{n_{hh}} = {n_{C{l_2}}} + {n_{{O_2}}} = 0,2} \hfill \\
\sum {{m_{hh}} = 71{n_{C{l_2}}} + 32{n_{{O_2}}} = 30,625.2.0,2} \hfill \\
\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}
{n_{C{l_2}}} = 0,15 \hfill \\
{n_{{O_2}}} = 0,05 \hfill \\
\end{gathered} \right.\)
Sau phản ứng thu được 2 muối có nồng độ bằng nhau → số mol 2 muối bằng nhau
→ Fe3+ điện phân hết, Cu2+ điện phân dư
BTNT "Cl": 3nFeCl3 = 2nCl2 → nFeCl3 = 2/3. 0,15 = 0,1 (mol)
→ nCu2+ dư = nFe2+ = nFe3+ = 0,1 (mol)
Đặt nCu2+ điện phân = a (mol)
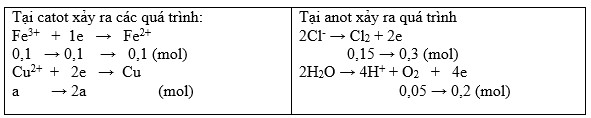
BT e ta có: 0,1 + 2a = 0,3 + 0,2 → a = 0,2 (mol)
BTNT "Cu": nCuSO4 = nCu2+ điện phân + nCu2+ dư = 0,2 + 0,1 = 0,3 (mol)
→ m = mCuSO4 + mFeCl3 = 0,3.160 + 0,1.162,5 = 64,25 (g)
Điện phân dung dịch X chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1:3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A. Sau thời gian điện phân t (giờ) thu được dung dịch Y (chứa 2 chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
nCuSO4 = x(mol); nNaCl = 3x (mol)
Dung dịch X chứa 2 chất tan gồm: Na+: 3x (mol); SO4 2-: x mol => nOH - = x mol
Mặt khác nAl2O3 = 0,03 (mol) => nOH - = 2nAl2O3 = 0,06 (mol)
Xét tại cực Catot: nCu = 0,06 mol; nH2 = a mol
Anot: nCl2 = 0,09 mol; nO2 = b mol
=> 0,06 * 64 + 2a + 0,09 * 71 +32b = 12,45 (1)
Áp dụng định luật bảo toàn điện tích: 2a - 4b = 0,06 (2)
Từ (1) và (2) => a = 0,15; b = 0,06
=> ne trao đổi = 0,42 (mol)
=> ne trao đổi= It/F => t = 5,63 h

