I. Định luật tuần hoàn các nguyên tố.
Tính chất của các nguyên tử cũng như thành phần tính chất các đơn chất và hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
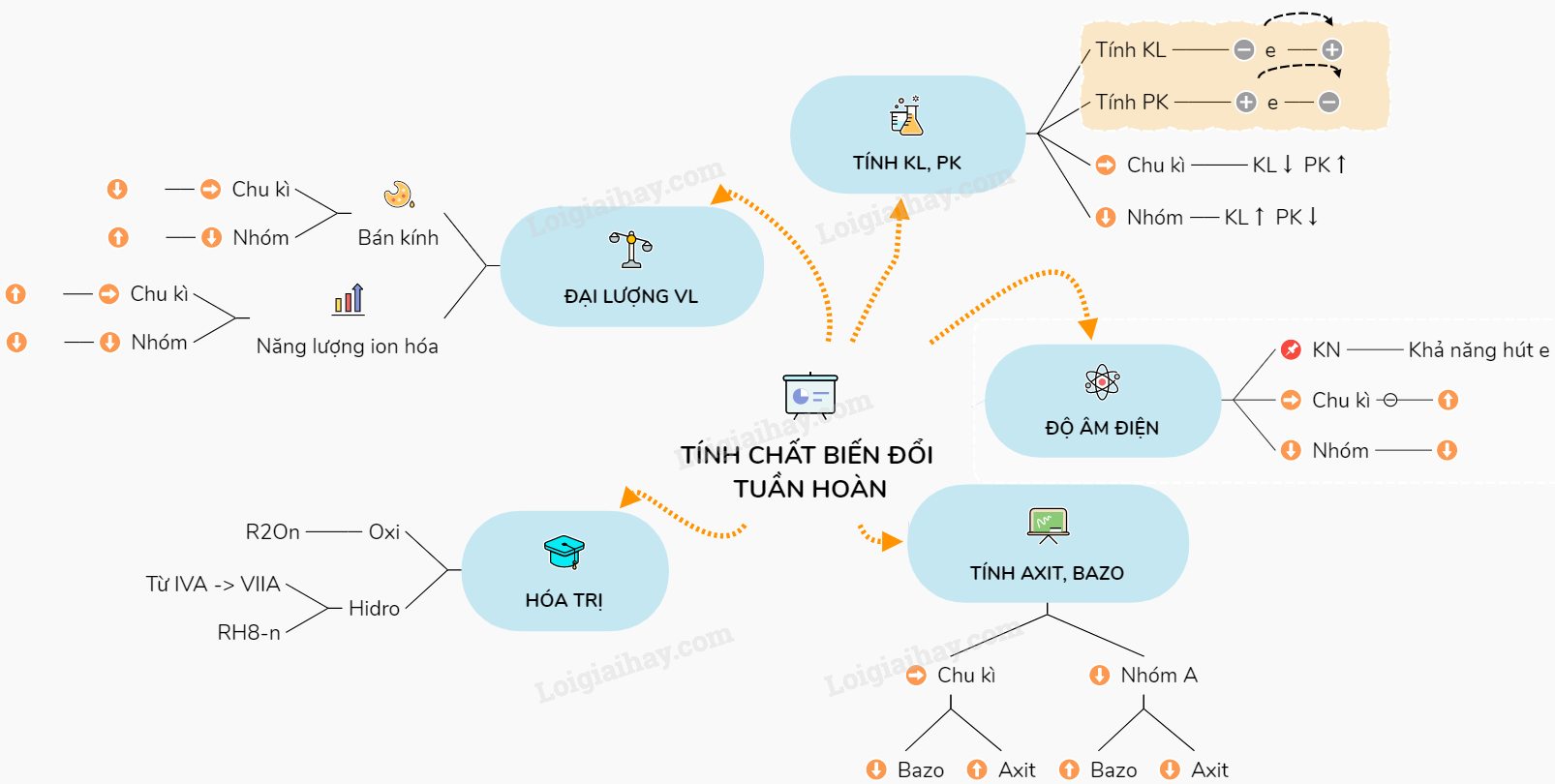
II. Những tính chất biến đổi tuần hoàn của các nguyên tố
- Trong một chu kì (theo chiều tăng của điện tích hạt nhân) trong một nhóm (theo chiều từ trên xuống dưới) được lặp lại ở các chu kì khác, nhóm khác theo cùng quy luật đó là:
1. Tính kim loại, phi kim
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương. Nguyên tử càng dễ mất electron thì tính kim loại của nguyên tố càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ thu electron để trở thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh.
- Trong cùng chu kỳ, khi điện tích hạt nhân tăng: Tính kim loại giảm, tính phi kim tăng dần.
- Trong cùng nhóm A, khi điện tích hạt nhân tăng: Tính kim loại tăng, tính phi kim giảm dần.
2. Độ âm điện
- Độ âm điện: của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học
Theo chiều tăng dần của điện tích hạt nhân:
+ Trong cùng chu kỳ, độ âm điện tăng.
+ Trong cùng nhóm, độ âm điện giảm.
3. Sự biến đổi tính axit - bazơ của oxit và hiđroxit.
+ Trong một chu kì: theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
+ Trong một nhóm A: theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần.
4. Sự biến đổi hóa trị
- Trong cùng chu kỳ, khi điện tích hạt nhân tăng , hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hidro giảm từ 4 đến 1.
Hóa trị đối với hidro = số thứ tự nhóm – hóa trị đối với oxi
- Công thức phân tử ứng với các nhóm nguyên tố ( R : là nguyên tố )
R2On: n là số thứ tự của nhóm.
RH8-n: n là số thứ tự của nhóm.
5. Sự biến đổi một số đại lượng vật lí
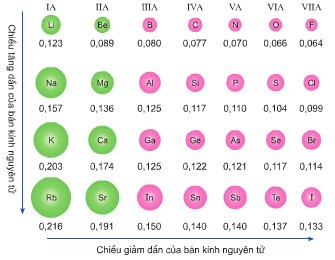
a. Sự biến đổi bán kính nguyên tử khi điện tích hạt nhân tăng:
+ Trong cùng chu kỳ : bán kính giảm.
+ Trong cùng nhóm A : bán kính tăng.
b. Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố nhóm A: Khi điện tích hạt nhân tăng:
+ Trong cùng chu kỳ năng lượng ion hóa tăng.
+ Trong cùng nhóm, năng lượng ion hóa giảm.
- Năng lượng ion hóa thứ nhất (I1) của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản. ( tính bằng Kj/mol)
Sơ đồ tư duy: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn