A. KIM LOẠI KIỀM
I. VỊ TRÍ VÀ CẤU TẠO NGUYÊN TỬ
Kim loại kiềm là những kim loại thuộc nhóm IA, đứng đầu các chu kì (trừ chu kì I) gồm có các nguyên tố
Liti Natri Kali Rubidi Xesi Franxi
=> Đây là những nguyên tố s, có 1e lớp ngoài cùng (ns1) nên những nguyên tử này dễ dàng nhường đi 1e để có được cấu hình bền khi tham gia phản ứng hóa học.
=> Kim loại kiềm có tính khử mạnh.
II. TÍNH CHẤT VẬT LÍ
- Liên kết kim loại yếu
- Là những kim loại rất nhẹ và mềm, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi thấp, giảm từ Li đến Fr.
- Độ cứng nhỏ
III. TÍNH CHẤT HÓA HỌC
- Các kim loại kiềm có tính khử mạnh: M → M+ + 1e.
- Trong mọi hợp chất, kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim
4Na + O2 → 2Na2O
K + Cl2 → 2KCl
2. Tác dụng với axit (HCl, H2SO4 loãng) để sinh ra muối mới + khí H2
2M + 2H+ → 2M+ + H2
2Na + 2HCl → 2NaCl + H2↑
Na dư + H2O → NaOH + 1/2 H2↑
3. Tác dụng với nước
Kim loại kiềm dễ dàng tác dụng với nước để sinh ra dung dịch kiềm tương ứng + khí H2
2M + H2O → 2MOH + H2
Na + H2O → NaOH + 1/2 H2↑
4. Tác dụng với dung dịch muối
- Khi cho Na tác dụng với dd muối CuSO4 sẽ có bọt khí và kết tủa Cu(OH)2 màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Khi cho kim loại kiềm vào dung dịch muối, đầu tiên kim loại kiềm sẽ tác dụng với nước sau đó bazo sinh ra có thể tác dụng với muối.
IV. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,...
- Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài loại lò phản ứng hạt nhân.
- Kim loại xesi dùng chế tạo tế bào quang điện.
- Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
- Kim loại kiềm được dùng làm chất xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế
Điện phân nóng chảy muối của kim loại kiềm.
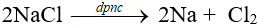
B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM
I. NATRI HIDROXIT (NaOH)
1.Tính chất vật lí
Là chất rắn, không màu dễ hút ẩm, dễ nóng chảy, tan nhiều trong nước
2. Tính chất hóa học
Mang đầy đủ tính chất của bazo điển hình (tác dụng với axit, oxit axit, một số dung dịch muối)
3. Điều chế
Điện phân dung dịch NaCl (có màng ngăn)
2NaCl + 2H2O \(\xrightarrow[c\text{ }\!\!\tilde{\mathrm{a}}\!\!\text{ vch ng }\!\!\ddot{\ }\!\!\text{ n}]{\text{i }\!\!\ddot{\mathrm{O}}\!\!\text{ n phn}}\) H2 + Cl2 + 2NaOH
II. NATRI HIDROCACBONAT (NaHCO3)
1. Tính chất vật lí
Là chất rắn, ít tan trong nước
2. Tính chất hóa học
- Bị phân hủy bởi nhiệt:
2NaHCO3 \(\xrightarrow{{{t}^{o}}}\) Na2CO3 + H2O + CO2
- NaHCO3 tác dụng với cả dung dịch axit và dung dịch bazo
NaHCO3 + HCl → NaCl + H2O + CO2
NaHCO3 + NaOH → Na2CO3 + H2O
=> NaHCO3 có tính lưỡng tính.
3. Ứng dụng
Natri hiđrocacbonat được dùng trong y học (làm thuốc chữa đau dạ dày) , công nghệ thực phẩm, chế tạo nước giải khát,...
III. NATRI CACBONNAT (Na2CO3)
1. Tính chất vật lí
Dễ tan trong nước, nóng chảy ở 850oC.
2. Tính chất hóa học
Là muối có khả năng tác dụng với dung dịch axit, một số dung dịch muối:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Na2CO3 + CaCl2 → 2NaCl + CaCO3
3. Ứng dụng
- Là nguyên liệu trong công nghiệp sản xuất thủy tinh, xà phòng, giấy, ....
- Dùng trong công nghiệp sản xuất chất tẩy rửa, ...
Sơ đồ tư duy: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm


