* Phương trình tổng quát :
2M + 2nHCl → 2MCln + nH2
2M + nH2SO4 → M2(SO4)n + nH2
Điều kiện: Kim loại là kim loại đứng trước H trong dãy hoạt động hóa học.
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Đặc điểm:
- Muối thu được có hóa trị thấp (đối với kim loại có nhiều hóa trị)
- Sau phản ứng sinh ra khí H2
Ví dụ: Fe + 2HCl → FeCl2 + H2
Cu không phản ứng HCl
* Phương pháp chung
- Bảo toàn nguyên tố: nCl = nHCl = 2nH2 ; nSO4 = nH2SO4 = nH2
- Bảo toàn khối lượng: mkim loại + mHCl = mmuối + mH2 hoặc mmuối = mkim loại + mgốc axit
- Bảo toàn electron: ne kim loại cho = ne H nhận
- Khối lượng dung dịch tăng = khối lượng kim loại phản ứng – khối lượng khí H2
- Bài toán hỗn hợp kim loại tan hết trong 1 axit (HCl hoặc H2SO4) tạo khí H2
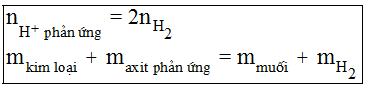
- Bài toán hỗn hợp kim loại tan hết trong hỗn hợp HCl và H2SO4 tạo khí H2
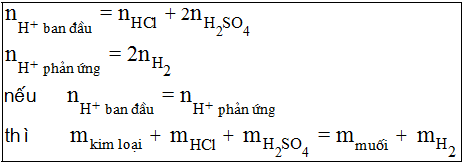
Nếu cho hỗn hợp kim loại kiềm, kiềm thổ tan hết trong hỗn hợp HCl và H2SO4
+) Kim loại tan trong axit trước, nếu axit hết kim loại mới tác dụng với nước
+) Khí H2 sinh ra có thể do kim loại tác dụng với axit và H2O

