I. Sự điện phân và các bước viết phương trình điện phân
1. Khái niệm
- Sự điện phân là quá trình oxi hóa – khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
- Trong quá trình điện phân, dưới tác dụng của điện trường các cation chạy về cực âm (catot) còn các anion chạy về điện cực dương (anot).
- Tại catot xảy ra quá trình khử cation (Mn+ + ne → M) còn tại anot xảy ra quá trình oxi hóa anion (Xn- → X + ne).
2. Các bước viết phương trình điện phân
K,Na,Ba,Ca,Mg,Al⏟ĐiệnphânnóngchảyZn,Fe,...,Pt,Au⏟Điệnphândungdịch
Bước 1: Xác định các cation và anion ứng với mỗi điện cực (ion dương chuyển về cực (-), ion âm chuyển về cực (+))
Bước 2: Viết quá trình cho – nhận e ở mỗi điện cực.
Bước 3: Viết PT điện phân
II. Điện phân chất điện li nóng chảy
Ví dụ 1: Điện phân NaCl nóng chảy có thể biểu diễn bằng sơ đồ:
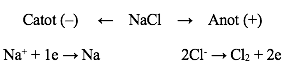
Phương trình điện phân: 2NaCl → 2Na + Cl2
Ví dụ 2: Điện phân Al2O3 nóng chảy pha thêm cryolite (Na3AlF6) có thể biểu diễn bằng sơ đồ:
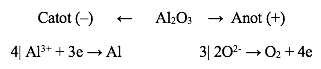
Phương trình điện phân là: 2Al2O3 → 4Al + 3O2
Bài tập áp dụng: Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
A. Ở catot (-): Na và ở anot (+): O2và H2O.
B. Ở catot (-): Na2O và ở anot (+): O2 và H2.
C. Ở catot (-): Na và ở anot (+): O2và H2.
D. Ở catot (-): Na2O và ở anot (+): O2 và H2O.
Lời giải:
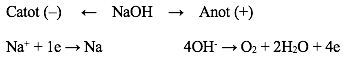
Phương trình điện phân là: 4NaOH → 4Na + O2 + 2H2O
=> Ở catot (-): Na và ở anot (+): O2 và H2O.
Đáp án: A
III. Điện phân dung dịch chất điện li trong nước
1. Quá trình điện phân ở catot
- Tại catot xảy ra quá trình khử cation (sau Al): Mn+ + ne → M
Ghi nhớ:
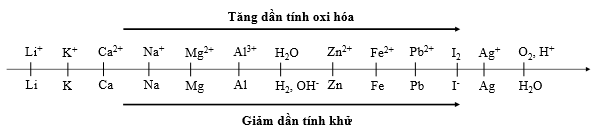
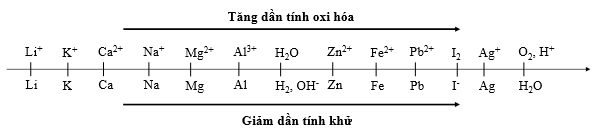
- Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+ thì H2O sẽ tham gia điện phân theo PT: 2H2O + 2e → H2 + 2OH-
- Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Ví dụ: điện phân dung dịch mà catot chứa các cation sau: Na+, Fe2+, Cu2+, H+. Thứ tự điện phân là
Cu2+ + 2e → Cu
2H+ + 2e → H2
Fe2+ + 2e → Fe
H2O + 2e → H2 + OH-
Na+ không bị điện phân
2. Quá trình điện phân ở anot
- Tại anot xảy ra quá trình oxyi hóa anion: Xn- → X + ne
+ Gốc acid không chứa oxygen như Cl-, S2-... hoặc ion OH- của base kiềm hoặc nước thì tham gia điện phân.
Ghi nhớ: Thứ tự anion bị oxyi hóa: S2– > I– > Br– > Cl– > RCOO– > OH– > H2O
Ví dụ: 2Cl- → Cl2 + 2e
4OH- → O2 + 2H2O + 4e
+ Gốc acid có chứa oxygen NO3–, SO42–, PO43–, CO32–, ClO4–… thì nước tham gia điện phân:
2H2O → O2 + 4H+ + 4e
- Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag…thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa – khử của chúng thấp hơn), và do đó chúng tan vào dung dịch (anot tan).
3. Một số ví dụ
- Điện phân dung dịch CuCl2 với anot trơ có thể biểu diễn bằng sơ đồ:
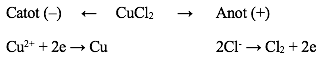
Phương trình điện phân: CuCl2 → Cu + Cl2
- Điện phân dung dịch NaCl bão hòa với điện cực trơ có màng ngăn có thể biểu diễn bằng sơ đồ:
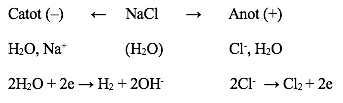
Phương trình điện phân: 2NaCl + 2H2O → 2NaOH + H2 + Cl2
Nếu không có màng ngăn thì: Cl2 + 2NaOH → NaCl + NaClO + H2O
=> Phương trình điện phân: NaCl + H2O → NaClO + H2
- Điện phân dung dịch NiSO4 với anot trơ có thể biểu diễn bằng sơ đồ:
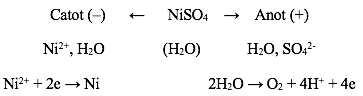
Phương trình điện phân là: 2NiSO4 + 2H2O → 2Ni + 2H2SO4 + O2
- Điện phân dung dịch NiSO4 với anot bằng Cu có thể biểu diễn bằng sơ đồ:
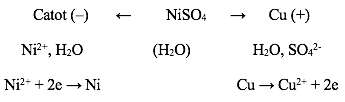
Phương trình điện phân là: NiSO4 + Cu → CuSO4 + Ni
- Điện phân dung dịch hỗn hợp chứa FeCl3, CuCl2 và HCl với anot trơ có thể biểu diễn bằng sơ đồ:
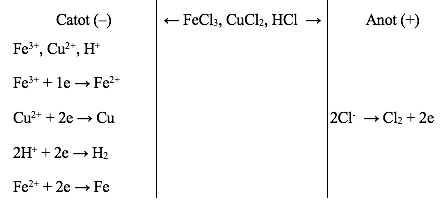
Bài tập áp dụng:
Bài 1: Điện phân với điện cực trơ, màng ngăn xốp một dung dịch chứa các ion Fe2+, Fe3+, Cu2+ và Cl-. Thứ tự điện phân xảy ra ở catot (theo chiều từ trái sang phải) là
A. Fe2+, Fe3+, Cu2+.
B. Fe2+, Cu2+, Fe3+.
C. Fe3+, Cu2+, Fe2+.
D. Fe3+, Fe2+, Cu2+.
Lời giải: Thứ tự điện phân là: Fe3+, Cu2+, Fe2+.
Đáp án: C
Bài 2: Ion Mg2+ bị khử trong trường hợp
A. Điện phân dung dịch MgCl2.
B. Điện phân MgCl2nóng chảy.
C. Thả Na vào dung dịch MgCl2.
D. Cho dd MgCl2tác dụng dd Na2CO3.
Lời giải: lon Mg2+ bị khử trong trường hợp: Điện phân MgCl2 nóng chảy.
Đáp án: B