1. Cấu trúc phân tử của amoniac và các amin
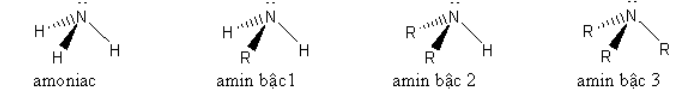
Trên nguyên tử nitơ đều có cặp electron tự do nên amoniac và các amin đều dễ dàng nhận proton. Vì vậy amoniac và các amin đều có tính bazơ
2. So sánh lực bazơ
- Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ.
p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
- Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
3. Chất chỉ thị màu
- Dung dịch metylamin và đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do có tính bazơ mạnh hơn amoniac.
- Dung dịch của anilin và các amin thơm không làm đổi màu quỳ tím và phenolphtalein.

