I. KHÁI NIỆM VỀ CẶP OXI HÓA - KHỬ
Tổng quát:
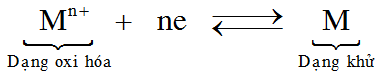
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử. Cặp oxi hóa – khử trên được viết như sau: Mn+/M
Ví dụ: cặp oxi hóa – khử Fe2+/Fe
Fe2+ + 2e $\overset{{}}{\leftrightarrows}$ Fe
Dạng oxi hóa Dạng khử
II. PIN ĐIỆN HÓA
1. Khái niệm về pin điện hóa, suất điện động và thế điện cực
- Suất điện động của pin (E) là hiệu của thế điện cực dương (E(+)) và điện cực âm (E(-)). Điện cực dương là điện cực có thế lớn hơn và suất điện động của pin luôn là số dương
E = E(+) – E(-)
- Suất điện động chuẩn của pin (Eo) là suất điện động khi nồng độ ion kim loại ở điện cực đều bằng 1M (ở 25oC)
Eo = Eo(+) – Eo(-) hoặc Eo = Eocatot – Eoanot
Ví dụ : Eo = EoCu2+/Cu – EoZn2+/Zn gọi là suất điện động chuẩn của pin điện hóa Zn – Cu
2. Cơ chế phát sinh dòng điện trong pin điện hóa
Giải thích hiện tượng của thí nghiệm:
- Lá Zn bị mất e (Zn bị oxi hóa: Zn → Zn2+ + 2e), Zn trở thành nguồn electron, đóng vai trò cực âm → Zn bị ăn mòn. Điện cực Zn được gọi là cực âm (anot)
- Trong cốc dung dịch CuSO4, các ion Cu2+ nhận e tạo thành Cu kim loại bám trên cực đồng: Cu2+ + 2e → Cu. Nồng độ Cu2+ trong dung dịch giảm dần → màu xanh trong dung dịch nhạt dần.
Điện cực Cu được gọi là cực dương (catot)
- Để duy trì được dòng điện trong quá trình hoạt động của pin điện hóa, người ta dùng cầu muối. Vai trò của cầu muối là trung hòa điện tích của 2 dung dịch: các ion dương Na+ hoặc K+ và Zn2+ di chuyển qua cầu muối đến cốc đựng dung dịch CuSO4. Ngược lại, các ion âm SO42- hoặc NO3- di chuyển qua cầu muối đến dung dịch ZnSO4
- Ở mạch ngoài (dây dẫn), dòng electron đi từ cực Zn sang cực Cu còn dòng điện đi từ cực Cu sang cực Zn. Vì thế điện cực Zn được gọi là anot (nơi xảy ra sự oxi hóa), điện cực Cu được gọi là catot (nơi xảy ra sự khử).
Trong pin điện hóa, anot là cực âm còn catot là cực dương
III. THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
1. Điện cực hiđro chuẩn
Quy ước rằng: thế điện cực của điện cực hiđro chuẩn 2H+/H2 bằng 0,00 V ở mọi nhiệt độ, tức là:
Eo2H+/H = 0,00 V
2. Thế điện cực chuẩn của kim loại
- Điện cực kim loại mà nồng độ ion kim loại trong dung dịch bằng 1M được gọi là điện cực chuẩn.
- Thế điện cực tiêu chuẩn của kim loại cần đo được chấp nhận bằng bằng suất điện động của pin tạo bởi điện cực hiđro chuẩn và điện cực chuẩn của kim loại cần đo.
Có 2 trường hợp xảy ra với giá trị của thế điện cực chuẩn:
+ Thế điện cực chuẩn của cặp Mn+/M là số dương nếu khả năng oxi hóa của ion Mn+ mạnh hơn ion H+
+ Thế điện cực chuẩn của cặp Mn+/M là số âm nếu khả năng oxi hóa của ion Mn+ yếu hơn ion H+
Ví dụ: Thế điện cực chuẩn của các cặp kim loại: EoZn2+/Zn = – 0,76 V ; EoAg+/Ag = + 0,80 V
IV. DÃY ĐIỆN HÓA CỦA KIM LOẠI
Dãy điện hóa của kim loại là dãy những cặp oxi hóa – khử của kim loại được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loai và giảm dần tính khử của kim loại (thứ tự tăng dần thế điện cực chuẩn)
Dãy điện hóa của một số kim loại thông dụng:
$\frac{{{K}^{+}}}{K}\,\,\frac{N{{a}^{+}}}{Na}\,\,\frac{M{{g}^{2+}}}{Mg}\,\,\frac{A{{l}^{3+}}}{Al}\,\,\frac{Z{{n}^{2+}}}{Zn}\,\,\frac{F{{e}^{2+}}}{Fe}\,\,\frac{N{{i}^{2+}}}{Ni}\,\,\frac{S{{n}^{2+}}}{Sn}\,\,\frac{P{{b}^{2+}}}{Pb}\,\,\frac{2{{H}^{+}}}{{{H}_{2}}}\,\,\frac{C{{u}^{2+}}}{Cu}\,\,\frac{F{{e}^{3+}}}{F{{e}^{2+}}}\,\,\frac{A{{g}^{+}}}{Ag}\,\,$
Khi làm bài tập về dãy điện hóa, chúng ta cần lưu ý các cặp oxi hóa khử sau
Fe2+/Fe Cu2+/Cu Fe3+/Fe2+ Ag+/Ag
V. Ý NGHĨA CỦA DÃY ĐIỆN HÓA CỦA KIM LOẠI
1. So sánh tính oxi hóa – khử
- Trong dung môi nước, thế điện cực chuẩn của kim loại EoMn+/M càng lớn thì tính oxi hóa của cation Mn+ càng mạnh và tính khử của kim loại M càng yếu và ngược lại
- Từ trái sang phải, tính khử của kim loại giảm, tính oxi hóa của cation tăng
2. Xác định chiều của phản ứng oxi hóa – khử
Quy tắc $\alpha $: Để viết đúng chiều của phản ứng oxi hóa – khử, người ta viết cặp oxi hóa – khử có thế điện cực chuẩn nhỏ ở bên trái, cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình theo quy tắc $\alpha $.
Phản ứng xảy ra theo chiều mũi tên, tức là : Cu + 2Ag+ → Cu2+ + 2Ag
3. Xác định suất điện động chuẩn của pin điện hóa
Eopin = Eo(+) – Eo(-)
Ví dụ: suất điện động chuẩn của pin điện hóa Zn-Cu :
${{E}^{o}}_{pin}=E_{C{{u}^{2+}}/Cu}^{o}-E_{Z{{n}^{2+}}/Zn}^{o}=0,34-(-0,76)=1,1\,\,V$

