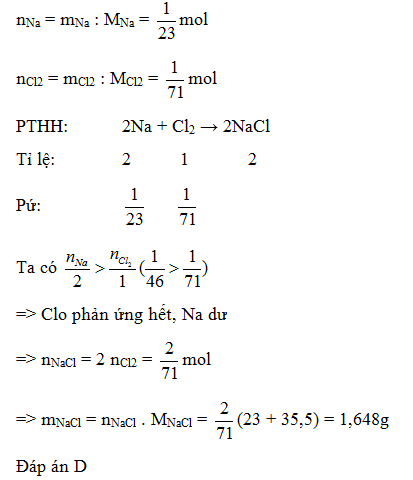Đốt cháy hoàn toàn 9,6 gam một kim loại M (chưa rõ hóa trị) trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 20,25 gam muối clorua. Kim loại M là
Gọi kim loại M có hóa trị n (n = 1, 2, 3, 4)
2M + nCl2 → 2MCln
+) Bảo toàn khối lượng: mkim loại + mCl2 = mmuối => mCl2 = 20,25 – 9,6 = 10,65 gam
$ = > {n_{C{l_2}}} = 0,15\,\,mol\,\, = > {n_M} = \frac{2}{n}.{n_{C{l_2}}} = \frac{{0,3}}{n}mol = > M = \frac{m}{n} = \frac{{9,6}}{{\frac{{0,3}}{n}}} = 32n$
Ta có bảng sau:

Vậy M là kim loại Cu
Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
${m_{{H_2}S{O_4}}} = \frac{{14,7.20}}{{100}} = 2,94\,gam\,\, = > {n_{{H_2}S{O_4}}} = 0,03\,\,mol$
nZn = 0,02 mol
Zn + H2SO4 → ZnSO4 + H2
Xét tỉ lệ: $\frac{{{n_{Zn}}}}{1} = \frac{{0,02}}{1} < \frac{{{n_{{H_2}S{O_4}}}}}{1} = \frac{{0,03}}{1}$ => Zn phản ứng hết, H2SO4 dư, tính số mol khí theo Zn
Ta có:
${n_{{H_2}}} = {n_{Zn}} = 0,02\,\,mol\,\, = > \,\,{m_{{H_2}}} = 0,02.2 = 0,04\,\,gam$
Hòa tan 2,7 gam kim loại A bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được 3,36 lít H2 (đktc). Kim loại A là:
${n_{{H_2}}} = \frac{{3,36}}{{22,4}} = 0,15mol$
Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
PTHH: 2A + nH2SO4 → A2(SO4)n + nH2
$\frac{{0,3}}{n}$ mol ← 0,15 mol
$ = > {M_A} = \frac{{2,7}}{{\frac{{0,3}}{n}}} = 9n$
Ta có bảng sau:

Vậy A là kim loại Al
Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4)
2R + nH2SO4 → R2(SO4)n + nH2
Ta có: ${n_R} = \frac{{1,08}}{R}\,\,mol;\,\,{n_{{R_2}{{(S{O_4})}_n}}} = \frac{{6,84}}{{2{\text{R}} + 96n}}\,\,mol$
Theo phản ứng: ${n_R} = 2.\,\,{n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{1,08}}{R} = 2.\frac{{6,84}}{{2{\text{R}} + 96n}}\,$
=> R = 9n
Ta có bảng sau:

Vậy R là kim loại Al
Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
\({n_{Zn}} = \dfrac{{6,5}}{{65}} = 0,1\,(mol)\)
PTPƯ: Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,1 (mol)
VH2(đktc) = 0,1 × 22,4 = 2,24 (lít)
Cho phản ứng hóa học: x… + H2SO4 -> FeSO4 + y…↑. Tổng (x + y) có thể là:
Fe + H2SO4 → FeSO4 + H2↑
=> Tổng (x+y) = 1+1 = 2
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl => chất rắn T là Cu
Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe
=> 1,6 = 64x – 56x
=> 1,6 = 8x
=> x = 0,2 (mol)
Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
Đặt số mol R = 1 (mol)
PTPƯ: R + H2SO4 → RSO4 + H2↑
1 →1 →1 →1 (mol)
\({m_{{H_2}S{O_4}}} = {n_{{H_2}S{O_4}}}.{M_{{H_2}S{O_4}}} = 1.98 = 98\,\,gam\)
\({m_{dung\,\,dich\,\,{H_2}S{O_4}}} = \dfrac{{{m_{{H_2}S{O_4}}}}}{{C\% }}.100\% = 1000\,\,(g)\)
Khối lượng dung dịch sau là:
\({m_{dung\,\,dich\,\,sau}} = {m_R} + {m_{dung\,\,dich\,\,{H_2}S{O_4}}} - {m_{{H_2}}} = R + 1000 - 1.2\)
\( \to {m_{dung\,\,dich\,\,sau}} = R + 998\) (g)
Muối Y là: RSO4: 1 (mol) \( \to\) mRSO4 = (R +96) g
Nồng độ phần trăm của muối Y là:
\(\eqalign{
& \% RS{O_4} = {{{m_{RS{O_4}}}} \over {{m_{dd\,sau}}}}.100\% \cr
& \Rightarrow 14,394\% = {{R + 96} \over {R + 998}}.100\% \cr
& \Rightarrow 14,394R + 14365,212 = 100R + 9600 \cr
& \Rightarrow 85,606R = 4765,212 \cr
& \Rightarrow R \approx 56(Fe) \cr} \)
Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
A. sai vì kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thích hợp) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Sai vì từ kim loại Mg trở về sau trong dãy điện hóa thì kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối
C. Sai vì phải là các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd HCl và H2SO4 loãng sinh ra khí hiđro và muối.
D. đúng
Cho các phương trình hóa học sau:
(1) Cu + Fe(NO3)2 → Fe + Cu(NO3)2.
(2) Al + FeSO4 → Fe + Al2(SO4)3
(3) Mg + CuCl2 → MgCl2 + Cu
(4) Ba + Na2SO4 + 2H2O → BaSO4 + 2NaOH + H2.
Số phương trình hóa học viết chưa đúng là
(1) sai vì phản ứng không xảy ra vì Cu là kim loại đứng sau Fe trong dãy điện hóa nên không đẩy được Fe ra khỏi dung dịch muối của nó.
(2) sai vì phương trình chưa được cân bằng
2Al + 3FeSO4 → 3Fe + Al2(SO4)3
(3) đúng
(4) đúng
Vậy có 2 phương trình chưa viết đúng
Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong điều kiện không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 0,5M phản ứng vừa đủ với chất rắn A thu được hỗn hợp khí B. Thể tích dung dịch HCl 0,5M đã dùng là
\({n_{F{\text{e}}}} = \dfrac{{5,6}}{{56}} = 0,1\,\,mol;{n_S} = \dfrac{{1,6}}{{32}} = 0,05\,\,mol\)
PTHH: Fe + S \(\buildrel {{t^0}} \over\longrightarrow \)FeS
Pư 0,05←0,05→0,05 (mol)
Vậy sau phản ứng rắn A thu được gồm: FeS: 0,05 (mol); Fe dư: 0,1 – 0,05 = 0,05 (mol)
Rắn A + dd HCl có phản ứng:
FeS + 2HCl → FeCl2 + H2S↑
0,05→ 0,1 (mol)
Fe + 2HCl → FeCl2 + H2↑
0,05→ 0,1 (mol)
\( \to\) tổng mol HCl = 0,1 + 0,1 =0,2 (mol)
\( \to\) \({V_{HCl}} = \dfrac{{{n_{HCl}}}}{{{C_M}}} = \dfrac{{0,2}}{{0,5}} = 0,4\,\,lít = 400\,\,ml\)
Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
\({n_{{H_2}S{O_4}}} = 0,5.0,08 = 0,04\,\,mol\) ; nHCl = 0,2.0,2 = 0,04 (mol); nKOH = 0,1.0,2 = 0,02 (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
R + 2HCl → RCl2+ H2↑ (2)
Trong hỗn hợp ban đầu \({n_{{H_2}S{O_4}}}:{n_{HCl}} = 0,04:0,04 = 1:1 \to \) phản ứng với R theo tỉ lệ 1: 1
\( \to\) Tỉ lệ của H2SO4 dư và HCl dư cũng là 1: 1
Đặt số mol H2SO4 dư = số mol HCl dư = x (mol)
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
x →2x (mol)
HCl + KOH → KCl + H2O (4)
x → x (mol)
\( \to\) tổng số mol KOH là: 2x + x = 0,02
\( \to\) x = \(\dfrac{1}{{150}}\) (mol)
\( \to\) \({n_{{H_2}S{O_4}(1)}} = 0,04 - \dfrac{1}{{150}} = \dfrac{1}{{30}}\) (mol)
nHCl(1) = 0,04 – \(\dfrac{1}{{150}}\) = \(\dfrac{1}{{30}}\) (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
\({1 \over {30}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {30}}\)
R + 2HCl → RCl2 + H2↑ (2)
\({1 \over {60}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {60}}\)
\( \Rightarrow \sum {{n_{{H_2}}} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {V_{{H_2}}}(dktc) = 0,05 \times 22,4 = 1,12(l)\) => C đúng
\( \Rightarrow \sum {{n_R} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {M_R} = {{{m_R}} \over {{n_R}}} = {{2,8} \over {0,05}} = 56\,(Fe)\) => A,B đúng
\(\% Fe = {{{m_{Fe}}} \over {{m_{FeS{O_4}}}}}.100\% = {{{1 \over {30}} \times 56} \over {{1 \over {30}} \times 152}}.100\% = 36,84\% \) => D sai
Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2 b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
HCl + (A) → MgCl2 + H2 => A là Mg
AgNO3 + (B) → Cu(NO3)2 + Ag => B là Cu
S + (C) → K2S => C là K(D) + Cl2 → ZnCl2 => D là Zn
Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
nAl = mAl : MAl = 1,35 : 27 = 0,05 mol
PTHH: 4Al + 3O2 → 2Al2O3
Tỉ lệ: 4 3 2
Pứ: 0,05 ? ?mol
Theo pthh ta có nO2 = ¾ . nAl = 3/4 . 0,05 = 0,0375 mol => mO2 = nO2 . MO2 = 0,0375 . 32 = 1,2g
nAl2O3 = ½ nAl = 0,025 mol => mAl2O3 = nAl2O3 . MAl2O3 = 0,025 . (27 . 2 + 48) = 2,55g
Cho 1 gam Na phản ứng với 1 gam khí clo. Khối lượng muối NaCl thu được là:
Cho một lượng Fe tác dụng với 100 ml dung dịch H2SO4 aM loãng, vừa đủ. Sau phản ứng thu được dung dịch chứa 22,8 gam muối sunfat và V lít khí H2 ở đktc. Giá trị của a và V lần lượt là?
\({n_{FeS{O_4}}}\)= 22,8/152 = 0,15 mol
Fe + H2SO4 → FeSO4 + H2
0,15 ← 0,15 → 0,15 (mol)
a = 0,15/0,1 = 1,5M
V = 0,15.22,4 = 3,36 lít
Đốt cháy hoàn toàn cùng một khối lượng các kim loại sau: Al, Mg, Zn, Cu ; kim loại nào cần dùng số mol khí O2 lớn nhất?
Đặt khối lượng các kim loại là m gam.
4Al + 3O2 \(\xrightarrow{{{t^o}}}\)2Al2O3.
m/27 m/36 (mol)
2Mg + O2 \(\xrightarrow{{{t^o}}}\)2MgO.
m/24 m/48 (mol)
2Zn + O2 \(\xrightarrow{{{t^o}}}\)2ZnO.
m/65 m/130 (mol)
2Cu + O2 \(\xrightarrow{{{t^o}}}\)2CuO.
m/64 m/128 (mol)
Đốt Al cần dùng số mol khí O2 lớn nhất.
Cho các kim loại sau: Fe, Ag, Hg, Zn. Số kim loại có thể dùng để điều chế Cu bằng phản ứng với dung dịch CuSO4 là?
Fe + CuSO4 → FeSO4 + Cu.
Zn + CuSO4 → ZnSO4 + Cu.
Có 2 kim loại Fe, Zn.
Kim loại nào sau đây không thể điều chế bằng phương pháp nhiệt luyện?
Phương pháp nhiệt luyện chỉ áp dụng với oxit kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (K đứng trước Al nên không thể điều chế bằng phương pháp nhiệt luyện).