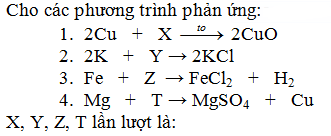Câu hỏi:
2 năm trước
Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
Trả lời bởi giáo viên
Đáp án đúng: c
${m_{{H_2}S{O_4}}} = \frac{{14,7.20}}{{100}} = 2,94\,gam\,\, = > {n_{{H_2}S{O_4}}} = 0,03\,\,mol$
nZn = 0,02 mol
Zn + H2SO4 → ZnSO4 + H2
Xét tỉ lệ: $\frac{{{n_{Zn}}}}{1} = \frac{{0,02}}{1} < \frac{{{n_{{H_2}S{O_4}}}}}{1} = \frac{{0,03}}{1}$ => Zn phản ứng hết, H2SO4 dư, tính số mol khí theo Zn
Ta có:
${n_{{H_2}}} = {n_{Zn}} = 0,02\,\,mol\,\, = > \,\,{m_{{H_2}}} = 0,02.2 = 0,04\,\,gam$
Hướng dẫn giải:
+) Xét tỉ lệ: $\frac{{{n_{Zn}}}}{1}$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1}$ => phản ứng tính theo chất hết
+) ${n_{{H_2}}} = {n_{Zn}}\,\, = > \,\,{m_{{H_2}}}$