Cho 8,4 gam Fe vào dung dịch chứa 0,4 mol AgNO3. Kết thúc phản ứng khối lượng muối thu được là.
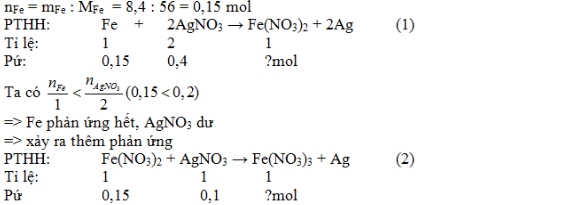
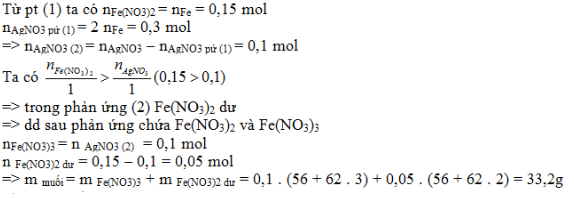
Ngâm một viên kẽm sạch trong dd CuSO4. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
Kẽm đứng trước Cu trong dãy điện hóa do đó đẩy được đồng ra khỏi dung dịch muối
Zn + CuSO4 → Cu + ZnSO4
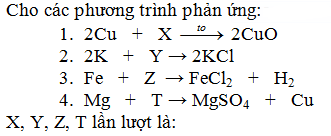
2Cu + X \(\xrightarrow{{{t^0}}}\) 2CuO => X là O2
2K + Y → 2KCl => Y là Cl2
Fe + Z → FeCl2 + H2 => Z là HCl
Mg + T → MgSO4 + Cu => T là CuSO4
Hoà tan 16,8g kim loại hoá trị II vào dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí H2 (đktc). Kim loại đem hoà tan là:
Gọi A là kim loại cần tìm
A + 2HCl → ACl2 + H2
nH2 = VH2 : 22,4 = 6,72 : 22,4 = 0,3 mol
từ pthh ta có nA = nH2 = 0,3 mol
=> MA = mA : nA = 16,8 : 0,3 = 56g/mol => A là sắt
Clo hoá 33,6g một kim loại A ở nhiệt độ cao thu được 97,5g muối ACl3. A là kim loại:
2A + 3Cl2 → 2ACl3
Áp dụng định luật bảo toàn khối lượng ta có
mA + mCl2 = mACl3 => mCl2 = mACl3 – mA = 97,5 – 33,6 = 63,9g
=> nCl2 = 0,9 mol
Từ PTHH ta có nA = 2/3 n Cl2 = 0,6 mol
=> MA = mA : nA = 33,6 : 0,6 = 56 (sắt)
Ngâm một lá sắt có khối lượng 20g vào dung dịch bạc nitrat, sau một thời gian phản ứng nhấc lá kim loại ra làm khô cân nặng 23,2g. Lá kim loại sau phản ứng có:
Gọi x là số mol của Fe tham gia phản ứng
PTHH: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
x 2x (mol)
ta có: m tăng = 23,2 - 20 = 3,2
=> mAg – mFe = 108. 2x – 56x = 3,2 => x = 0,02
=> m Fe còn lại = 20 - 0,02 . 56 = 18,88(g)
mAg = 0,04 . 108 = 4,32g
Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4 . Xảy ra hiện tượng:
- Nhôm đứng trước đồng trong dãy điện hóa do đó sẽ đẩy đồng ra khỏi muối
2CuSO4 + 2Al → 3Cu↓ + Al2(SO4)3
- Hiện tượng: Có chất rắn màu đỏ (Cu) bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần do tạo dung dịch Al2(SO4)3.
Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
2M + 3Cl2 → 2MCl3 (1)
Áp dụng định luật bảo toàn khối lượng ta có
mCl2 + mM = mMCl3
=> mCl2 = mMCl3 – mCl2 = 53,4 – 10,8 = 42,6g
=> nCl2 = mCl2 : MCl2 = 42,6 : 71 = 0,6 mol
Từ pt (1) ta có nM= 2/3 . nCl2 = 2/3 . 0,6 = 0,4 mol
=> MM = mM : nM = 10,8 : 0,4 = 27g/mol
=> M là nhôm
Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là :
nH2 = VH2 : 22,4 = 3,36 : 22,4 = 0,15 mol
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Tỉ lệ: 2 3
Pứ: ? mol 0,15
Từ pthh ta có nAl = 2/3 nH2 = 2/3 . 0,15 = 0,1 mol
=> mAl = nAl . MAl = 0,1 . 27 = 2,7g
Cho 1,35g Al vào dung dịch chứa 7,3g HCl. Khối lượng muối nhôm tạo thành là

Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
Phản ứng hóa học xảy ra là:
Fe + CuSO4 -> FeSO4 + Cu.↓
Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là :
Gọi công thức của oxit là A2O3
Ta có A2O3 + 6HCl → 2ACl3 + 3H2O
Từ pthh ta có nA2O3 = 1/6 nHCl = 1/6 . 0,3 = 0,05 mol
=> MA2O3 = mA2O3 : nA2O3 = 5,1 : 0,05 = 102
MA2O3 = 2 . MA + 3 . 16 = 2MA + 48 = 102
=> MA = 27 => A là nhôm
Cho 17g oxit M2O3 tác dụng hết với dung dịch H2SO4 thu được 57g muối sunfat. Nguyên tử khối của M là:
PTHH: M2O3 + 3H2SO4 → M2(SO4)3 + 3H2O
1mol 1mol → m tăng = (2M + 96 . 3) – (2M + 48) = 240g
a mol a mol → m tăng = 57 – 17 = 40g
=> a = 40 : 240 = 1/6 mol
=> M M2O3 = mM2O3 : nM2O3 = 17 : (1/6) = 102
=> MM = 27 (nhôm)
Đốt nhôm trong bình khí Clo . Sau phản ứng thấy khối lượng chất rắn trong bình tăng 7,1g . Khối lượng nhôm đã tham gia phản ứng là :
2Al + 3Cl2 → 2AlCl3
Dễ thấy m chất rắn tăng = mCl2 = 7,1g
=> nCl2 = 0,1 mol
nAl = 2/3 nCl2 = 1/15 mol
=> mAl = nAl . MAl = 1/15 . 27 = 1,8g
Hòa tan 25,8g hỗn hợp gồm bột Al và Al2O3 trong dung dịch HCl dư. Sau phản ứng người ta thu được 0,6g khí H2. Khối lượng muối AlCl3 thu được là :
nH2 = mH2 : MH2 = 0,6 : 2 = 0,3 mol
2Al + 6HCl → 2AlCl3 + 3H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
Theo pt (1) ta có nAl = 2/3 nH2 = 0,2 mol
=> mAl2O3 = mhh – mAl = 25,8 – 0,2 , 27 = 20,4g
=> nAl2O3 = mAl2O3 : MAl2O3 = 20,4 : (27 . 2 + 48) = 0,2 mol
nAlCl3 = nAlCl3 (1) + nAlCl3 (2) = nAl + 2nAl2O3 = 0,6 mol
=> mAlCl3 = 0,6 . 133,5 = 80,1g
Cho 5,4 (g) bột nhôm vào 60 (ml) dung dịch AgNO3 1M. Lắc kĩ để phản ứng xảy ra hoàn toàn. Sau phản ứng thu được m (g) chất rắn. Tính m?
Phản ứng sai là:
Ag không phản ứng với oxi ở nhiệt độ thường
Cặp chất nào có tính chất hoá học tương tự nhau:
A Mg là kim loại còn S là phi kim do đó tính chất hóa học trái nhau
B, D tương tự A
KL nào sau đây tác dụng với dd HCl loãng và tác dụng với khí Clo cho cùng loại muối clorua kim loại
Để tác dụng với HCl và khí clo cho cùng 1 muối khi kim loại đó chỉ có 1 số oxi hóa và đứng trước H2 trong dãy điện hóa
Cho phản ứng: Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O
Tỉ lệ x, y là:
Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O
Số nguyên tử Fe bên trái = số nguyên tử Fe bên phải
=> 3 = x + y (1)
Số nguyên tử Cl bên trái = số nguyên tử Cl bên phải
=> 8 = 2x + 3y (2)
Từ (1) và (2) => x = 1 ; y = 2


