Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Muối rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao là CaSO4.
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
Muối không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao là CaCO3.
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
Muối không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó là NaCl.
Không được phép có trong nước ăn vì tính độc hại của nó?
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Không được phép có trong nước ăn vì tính độc hại của nó?
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Súc miệng bằng dung dịch nước muối 0,9% có tác dụng bảo vệ niêm mạc và sát khuẩn. Số gam NaCl cần lấy để pha 300 gam dung dịch nước muối 0,9% là:
![]()
Điện phân 500 ml dung dịch muối NaCl (có màng ngăn) thu được 17,92 lít Cl2 (đktc). Số mol NaOH được tạo thành là:
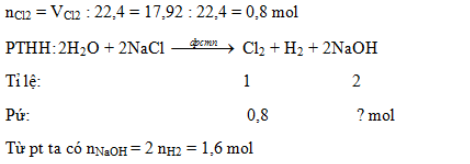
Điện phân dung dịch natri clorua (NaCl) bão hoà trong bình điện phân có màng ngăn ta thu được hỗn hợp khí là:
![]()
Để nhận biết 3 chất rắn NH4NO3 , Ca3 (PO4)2, KCl người ta dùng dung dịch :
Lấy mẫu thử của 3 chất rắn
Nhỏ từ từ dd Ba(OH)2 vào từng mẫu thử
+ Chất rắn tan và xuất hiện khí có mùi khai là NH4NO3
Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
+ Chất rắn không tan là Ca3 (PO4)2
+ Chất rắn tan không có hiện tượng là KCl(KCl chỉ tan vào nước có trong dd Ba(OH)2 chứ không xảy ra phản ứng hóa học).
Chất nào trong những thuốc thử sau đây có thể phân biệt dung dịch Na2SO4 và dung dịch Na2CO3:
Nhỏ HCl vào ống nghiệm chứa Na2SO4 và Na2CO3
+ Na2SO4 không có hiện tượng
+ Na2CO3 có xuất hiện sủi bọt khí
Na2CO3 + HCl → NaCl + CO2↑ + H2O
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính thể tích dung dịch MgSO4 2M cần dùng
Đổi 200 ml = 0,2 (lít)
nKOH = VKOH. CM KOH = 0,2.1 = 0,2 (mol)
PTHH: 2KOH + MgSO4→ Mg(OH)2↓ + K2SO4
Theo PTHH: nMgSO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
→ Thể tích dung dịch MgSO4 2M cần dùng là: VMgSO4 = nMgSO4: CM = 0,1 : 2 = 0,05 (lít)
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính nồng độ mol/lit dung dịch sau phản ứng.
Dung dịch sau phản ứng thu được chứa K2SO4
Theo PTHH: nK2SO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
Thể tích dung dịch thay đổi không đáng kể nên:
Vsau = VKOH + VMgSO4 = 0,2 + 0,05 = 0,25 (lít)
Nồng độ mol/lít của dd K2SO4 thu được sau phản ứng là: CM K2SO4 = nK2SO4 : Vsau = 0,1 : 0,25 = 0,4 (M)
Cho V (lít) CO2(đktc) vào 200ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Cho tiếp Ca(OH)2 đến dư vào dung dịch thu được thì lại thu được kết tủa. Tính V
200 ml = 0,2 (lít)
nCa(OH)2 = V. CM = 0,2.1 = 0,2 (mol)
nCaCO3 = mCaCO3 : MCaCO3 = 15 : 100 = 0,15 (mol)
Do khi cho Ca(OH)2 đến dư vào dung dịch thu được sau phản ứng của CO2 và Ca(OH)2 nên trong dung dịch sau phản ứng có Ca(HCO3)2. Cả CO2 và dd Ca(OH)2 cùng phản ứng hết.
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
(mol) x ← x → x
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
2y ← y (mol)
dd thu được chứa Ca(HCO3)2 nên có phản ứng:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O (3)
Đặt số mol Ca(OH)2(1) = x (mol) và mol Ca(OH)2 (2) = y (mol)
Theo PTHH (1) và (2) ta có: nCa(OH)2 = x + y = 0,2 (mol)
Theo PTHH (1) ta có: nCaCO3 = x = 0,15 (mol)
Thay x vào (*) ⟹ y = 0,05 (mol)
⟹ nCO2 = x + 2y = 0,15 + 2.0,05 = 0,25 (mol)
⟹ VCO2(đktc) = nCO2×22,4 = 0,25×22,4 = 5,6 (lít)
Nhiệt phân hoàn toàn 20 g hỗn hợp MgCO3, CaCO3 , BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong thu được 10 gam kết tủa và dung dịch C. Đun nóng dung dịch C tới phản ứng hoàn toàn thấy tạo thành thêm 6 gam kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào?
ân hoàn toàn hỗn hợp:
(1) MgCO3 \(\xrightarrow{{{t^o}}}\) MgO + CO2
(2) CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2
(3) BaCO3 \(\xrightarrow{{{t^o}}}\) BaO + CO2
- Do khi đun nóng dung dịch C lại thu thêm kết tủa nên CO2 phản ứng với Ca(OH)2 tạo thành CaCO3 và Ca(HCO3)2: nCaCO3 = 10 : 100 = 0,1 mol
(4) CO2 + Ca(OH)2 → CaCO3↓ + H2O
(5) 2CO2 + Ca(OH)2 → Ca(HCO3)2
- Đun nóng dung dịch C thì Ca(HCO3)2 bị phân hủy:
(6) Ca(HCO3)2 \(\xrightarrow{{{t^o}}}\) CaCO3 + CO2 + H2O
Từ (4): nCaCO3(4) = nCO2(4) = 10/100 = 0,1 mol
Từ (6) nCaCO3(6) = nCa(HCO3)2(6) = nCa(HCO3)2(5) = 6/100 = 0,06 mol => nCO2(5) = 2.0,06 = 0,12 mol
=> nCO2 = 0,1 + 0,12 = 0,22 mol
Từ (1) (2) (3) => n hỗn hợp = nCO2 = 0,22 mol
Đặt số mol của MgCO3, CaCO3, BaCO3 lần lượt là x, y, z.
+ m hh = 84x + 100y + 197z = 20 (1) => mCaCO3, BaCO3 = 20 - 84x (g)
+ n hh = x + y + z = 0,22 (2) => nCaCO3, BaCO3 = y + z = 0,22 - x (mol)
Ta có:
\({M_{CaC{O_3}}} < {\overline M _{CaC{O_3},BaC{O_3}}} < {M_{BaC{O_3}}} \Leftrightarrow 100 < \frac{{20 - 84x}}{{0,22 - x}} < 197\)
=> 0,125 < x < 0,20655
=> 10,5 (g) < mMgCO3 < 17,35 (g)
=> 52,5% < %mMgCO3 < 86,75%
Không được phép có trong nước ăn vì tính độc hại của nó?
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Khi làm nguội 1026,4 gam dung dịch bão hòa R2SO4. nH2O (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7< n< 12) từ 800C xuống 100C thì có 395,4 gam tinh thể R2SO4. nH2O tách ra khỏi dung dịch. Biết độ tan của R2SO4 ở 800C và 100C lần lượt là 28,3 gam và 9 gam. Công thức phân tử của hiđrat nói trên là:
Độ tan của R2SO4 ở 800C là 28,3 gam
→ trong 1026,4 g dd có: \({m_{{R_2}S{O_4}\,}} = \,\,\frac{{1026,4}}{{100 + 28,3}}.28,3 = \,226,4(g)\)
Khi làm lạnh thì mdd =1026,4 -395,4= 631g
→ dd có: \({m_{{R_2}S{O_4}({{10}^o}C)}}\,\, = \,\,\frac{{631}}{{100 + 9}}.9\, = \,52,1g\)
Ta có: \({m_{{R_2}S{O_4}(tinh{\text{ }}thể)}} = 226,4{\text{ }}-{\text{ }}52,1{\text{ }} = {\text{ }}174,3g\)
→ \({m_{{H_2}O}}\, = \,395,4\, - \,174,3\, = \,221,1g\ → \({n_{{H_2}O}}{\mkern 1mu} = {\mkern 1mu} \,\frac{{737}}{{60}}mol\)
→ \({n_{{R_2}S{O_4}}}\, = \frac{{737}}{{60n}} \to {M_{{R_2}S{O_4}}} = 2R + 96 = \frac{{174,3}}{{{n_{{R_2}S{O_4}}}}} = 14,19n\)
Với 7 <n< 12 thỏa mãn n=10 và R =23
Vậy CTPT của hiđrat là: Na2SO4.10H2O
Trong tự nhiên muối natri clorua có nhiều trong:
Trong tự nhiên muối natri clorua có nhiều trong: nước biển
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
Không được phép có trong nước ăn vì tính độc hại của nó?
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
Muối không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó là NaCl.
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
Muối không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao là CaCO3.

