Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HCl, sau phản ứng thu được V lít H2 (đktc). Giá trị của V là:
\({n_{F{\text{e}}}} = \dfrac{{5,6}}{{56}} = 0,1\,\,(mol)\)
PTPƯ: Fe + 2HCl → FeCl2 + H2↑
0,1 → 0,1 (mol)
\( \to {V_{{H_2}(dktc)}} = 0,1.22,4 = 2,24\,\,lít\)
Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
\({n_{F{\text{e}}}} = \dfrac{{5,6}}{{56}} = 0,1\,\,mol\);
nHCl = 0,25.1 = 0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Ban đầu 0,1 0,25 (mol)
PƯ 0,1 → 0,2 → 0,1 (mol)
Sau PƯ 0 0,05
Dd X thu được gồm: FeCl2: 0,1 mol và HCl dư 0,05 mol
Vì T phản ứng được với Na2CO3 sinh ra khí \( \to\) T là HCl
\( \to\) CM HCl dư = nHCl : VHCl = 0,05 : 0,25 =0,2 (M)
Cho sơ đồ phản ứng sau: A + NaOH → NaAlO2 + H2O. A là chất nào trong số các chất sau:
Al2O3+ 2NaOH →2 NaAlO2 + H2O
Hoặc Al(OH)3 + NaOH → NaAlO2 + 2H2O
Cho 4,6 gam một kim loại M hóa trị I phản ứng với khí Clo tạo thành 11,7g muối. M là kim loại nào sau đây?
Ta có PTHH
2M + Cl2 → 2MCl
![]() →
→![]()
→mMCl = ![]() .(M+35,5) =11,7 → M =23 (Na)
.(M+35,5) =11,7 → M =23 (Na)
Dung dịch muối ZnSO4 có lẫn một ít tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4 nêu trên là dễ dàng nhất?
Ta dùng kim loại Zn để làm sạch
Zn + CuSO4 → ZnSO4 + Cu↓
Phương pháp nhiệt luyện dùng để điều chế
Phương pháp nhiệt luyện dùng để điều chế các kim loại hoạt động trung bình
Hòa tan hoàn toàn 19,5 gam Zn bằng dung dịch HCl thu được thể tích khí H2 (ở đktc) là
nZn = mZn : MZn = 19,5 : 65 = 0,3 (mol)
PTHH: Zn + 2HCl → ZnCl2 + H2↑
Theo PTHH: nH2 = nZn = 0,3 (mol)
⟹ VH2(đktc) = nH2×22,4 = 0,3×22,4 = 6,72 (lít)
Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al cần phải dùng hóa chất nào sau đây là thích hợp nhất?
Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al cần phải dung : NaOH và HCl vì
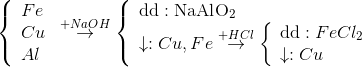
Nhúng 1 thanh Al nặng 50 gam vào 400ml dung dịch CuSO4 0,5M. Sau một thời gian, lấy thanh Al ra cân nặng 51,38 gam. Khối lượng Cu đã giải phóng là:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
PT: 2 mol 3 mol → m thanh Al tăng = 3.64 - 2.27 = 138 gam
ĐB: 0,02 mol 0,03 mol ← m thanh Al tăng = 1,38 gam
→ mCu = 0,03.64 = 1,92g
Chất nào sau đây không phản ứng với dung dịch HCl
SO2 là oxit axit nên không phản ứng được với HCl
Axit sunfuric loãng tác dụng được với dãy chất nào sau đây?
H2SO4 loãng tác dụng được với oxit bazơ, bazơ, kim loại đứng trước H, muối
A. Loại CO2
B. Loại Cu
C. Loại H2O, SO3
D. Thỏa mãn
Tính chất hóa học chung của kim loại gồm:
Tính chất hóa học chung của kim loại gồm: tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
Phản ứng đúng là: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy nào dưới đây?
Axit H2SO4 loãng phản ứng được với: Al, Al2O3, Fe(OH)3, BaCl2
Loại A vì Cu không phản ứng
Loại B vì Ag không phản ứng
Loại C vì SO2 không phản ứng
Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai ?
Kết luận sai là: Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
Cho phản ứng: Zn + CuSO4 → muối X + kim loại Y. X là
Zn + CuSO4 → ZnSO4 + Cu
=> muối X là ZnSO4
Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào ?
Để thu được dung dịch chứa duy nhất muối ZnSO4 thì cần loại bỏ được dung dịch FeSO4 và không tạo ra muối nào khác
=> kim loại sử dụng được là Zn
PTHH: Zn + FeSO4 → ZnSO4 + Fe
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là:
Giả sử kim loại A có hóa trị n (n = 1, 2, 3, 4)
=> công thức oxit của kim loại A là A2On
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng
$ = > \% {m_O} = \frac{{16n}}{{2.{M_A} + 16n}}.100\% = 17,02\% $
=> 16n = 0,1702.(2.MA + 16n) => MA = 39n
Ta có bảng sau:

Vậy A là Kali
Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4)
4R + xO2 $\xrightarrow{{{t^o}}}$ 2R2Ox
Theo đề bài ta có: $\frac{{32{\text{x}}}}{{4{\text{R}}}} = 0,4\,\, = > R = 20{\text{x}}$
Ta có bảng sau:
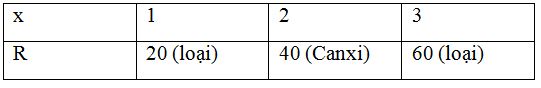
Vậy R là Canxi
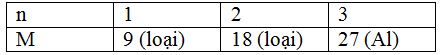
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
nHCl = 2 mol
Gọi kim loại M có hóa trị n (n = 1, 2, 3)
2M + 2nHCl → 2MCln + nH2
$\dfrac{2}{n}$ ← 2 mol
$ = > M = \dfrac{{18}}{{\dfrac{2}{n}}} = 9n$
Ta có bảng sau: