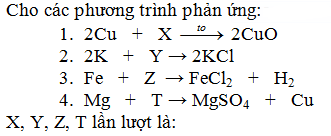Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
Trả lời bởi giáo viên
\({n_{F{\text{e}}}} = \dfrac{{5,6}}{{56}} = 0,1\,\,mol\);
nHCl = 0,25.1 = 0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Ban đầu 0,1 0,25 (mol)
PƯ 0,1 → 0,2 → 0,1 (mol)
Sau PƯ 0 0,05
Dd X thu được gồm: FeCl2: 0,1 mol và HCl dư 0,05 mol
Vì T phản ứng được với Na2CO3 sinh ra khí \( \to\) T là HCl
\( \to\) CM HCl dư = nHCl : VHCl = 0,05 : 0,25 =0,2 (M)
Hướng dẫn giải:
Bước 1: Đổi số mol Fe, HCl
Bước 2: Viết PTHH, tính toán số mol HCl pư theo số mol Fe
Bước 3: Kết luận được T là HCl dư \( \to\) số mol HCl dư = ?